Арцерикс

Состав
Гофликицепт представляет собой гибридный белок, гетеродимер с молекулярной массой негликозилированной формы 126,8 килодальтон (кДа). Получен с использованием клеток яичника китайского хомячка (СНО) по технологии рекомбинантной ДНК.
Качественный и количественный состав
Действующее вещество: гофликицепт.
Каждый мл раствора для подкожного введения содержит 40 мг гофликицепта.
Каждый флакон раствора для подкожного введения объемом 2 мл содержит 80 мг гофликицепта.
Вспомогательные вещества, наличие которых надо учитывать в составе лекарственного препарата: натрий.
Полный перечень вспомогательных веществ:
- Сахароза
- Полиэтиленгликоль 3350
- Натрия хлорид
- Гистидин
- Вода для инъекций.
Лекарственная форма
Раствор для подкожного введения.
Прозрачный или опалесцирующий раствор от бесцветного до светло-желтого цвета.
Характер и содержание первичной упаковки
По 2 мл препарата во флаконы из бесцветного боросиликатного стекла (тип I) вместимостью 4 мл, укупоренных пробками из хлорбутилкаучука или бромбутилкаучука и закрытых колпачком комбинированным алюминиевым с пластмассовой отщелкивающейся крышкой. По 1 флакону вместе с листком-вкладышем помещают в картонную пачку.
Фармакодинамика
Механизм действия
Гофликицепт представляет собой гибридный белок, гетеродимер с молекулярной массой негликозилированной формы 126,8 килодальтон (кДа), селективно связывающий и инактивирующий интерлейкин-1 бета (ИЛ-1β), с меньшим сродством гофликицепт связывается с интерлейкином-1 альфа (ИЛ-1α) и антагонистом к рецептору интерлейкина 1 (ИЛ-1РА).
Структурно молекула гофликицепта включает последовательность из 18-333аминокислот человеческого ИЛ-1R1 и последовательность из 21-358 аминокислот человеческого ИЛ1RAcP, каждая из которых содержит 7 ковалентно связанных гликанов и связана с уникальным Fc-фрагментом человеческого IgG1, также несущего один гликан. Гофликицепт получают путем фармацевтического культивирования клеток яичника китайского хомячка (СНО) в крупномасштабном производстве.
ИЛ-1 является цитокином, который играет ключевую роль в развитии многих воспалительных процессов и рассматривается как причина развития рецидивирующего перикардита. Избыточная продукция ИЛ-1α, высвобождаемого из поврежденных перикардиальных клеток, а также ИЛ-1 β, высвобождаемого из клеток воспаления (моноцитов, макрофагов) посредством активации инфламмасомы, приводит к запуску каскада воспаления при связывании этих провоспалительных цитокинов с мембранным рецептором ИЛ-1 первого типа. Гофликицепт, связывая ИЛ-1 β и ИЛ-1α, препятствует их взаимодействию с рецептором ИЛ-1 первого типа, таким образом происходит блокировка сигнала воспаления. Ингибирование ИЛ-1 приводит к снижению уровня маркеров воспаления (С-реактивного белка), уменьшению выраженности боли в грудной клетке, размеров перикардиального выпота и снижение риска повторных рецидивов.
Фармакодинамические эффекты
В исследовании 2/3 фазы CL04018068 у пациентов с идиопатическим рецидивирующим перикардитом при многократном введении гофликицепта в обеих группах (дозирования) в течение 10 недель подготовительного периода было продемонстрировано снижение содержания СРБ в сыворотке крови. Среднее значение содержания СРБ в сыворотке крови составляло 5,51 (5,43) мг/Л до введения препарата, 2,59(2.74) мг/Л, 1.91 (2.24) мг/Л,
1.78 (2.20) мг/Л, 1.36 (1.21) мг/Л, 1.49 (1.30) мг/Л, 1.78 (1.92) мг/Л, 3.06 (4.00) мг/Л, 2.13 (2.69) мг/Л через 3,7, 14, 28,42,56, 70 и 84/168 дней соответственно, в течение всего периода терапии. В течение периода терапии не было отмечено рецидива перикардита.
В течение периода рандомизированной терапии при регистрации рецидива и возобновлении терапии в группе плацебо, было отмечено снижение СРБ в сыворотке крови. Среднее значение содержания СРБ в сыворотке крови составляло 10.07 (11.06) при регистрации рецидива, 3.62 (4.06), 15.57 (36.93), 2.07 (1.59) через 3, 7 и 14 дней соответственно. Разрешение рецидива оценивали через 14 дней после возобновления терапии. После разрешения рецидива при возобновлении терапии препаратом последующих (повторных) рецидивов отмечено не было на момент среза данных 05.10.2021
Клиническая эффективность и безопасность
Эффективность подкожного введения гофликицепта в дозе 80 мг каждые 2 недели (к2н) и с применением нагрузочно-индукционного режима 160 мг-80-80 и далее каждые 2 недели изучалось в двойном-слепом, плацебо контролируемом исследовании с периодом рандомизированной отмены. Исследование включало 2 периода терапии: подготовительный и период рандомизированной отмены. В периоде подготовительной терапии все пациенты получали гофликицепт в открытом режиме. Часть пациентов (n=10) получали гофликицепт в дозе 80 мг каждые 2 недели (к2н), часть пациентов (n=12) получали гофликицепт с применением нагрузочно-индукционного режима: День 0 — 160 мг, День 7 — 80 мг, День 14 — 80 мг и далее каждые 2 недели 80 мг подкожно. В периоде рандомизированнной отмены все пациенты получали гофликицепт 80 мг или плацебо в заслепленном режиме. Критерием ответа на терапию исследуемым препаратом являлись ответ пациента на разрешение рецидива и отсутствие новых рецидивов перикардита на фоне терапии гофликицептом. Ответ на терапию оценивался через 14 дней после начала применения гофликицепта.
Критерием разрешения рецидива заболевания являлось наличие всех следующих признаков одновременно:
- балл интенсивности боли в грудной клетке по ЦРШ ≤ 3 И
- уровень СРБ ≤ 5 мг/л И
- отсутствие или малый (< 10 мм) выпот в полость перикарда в диастолу по данным ЭхоКГ
Критерием развития рецидива заболевания являлось появление как минимум двух из следующих признаков:
- балл интенсивности боли в грудной клетке по ЦРШ > 3 (при отсутствии других возможных причин повышения интенсивности боли);
- уровень СРБ > 5 мг/л (при отсутствии других возможных причин повышения уровня СРБ)
- появление нового или прогрессирование имевшегося выпота в полости перикарда в диастолу по данным Эхо-КГ
Исследование включало в общей сложности 22 пациента. 22 пациента завершили период подготовительный период, в данном периоде через 14 дней после начала терапии гофликицептом у 21 пациента был отмечен ответ на терапию и далее не было отмечено рецидива перикардита на терапии препаратом; 20 пациентов были рандомизированы в соотношении 1:1 (группа препарата и группа плацебо) пецтв двойной-слепой, плацебоконтролируемый период рандиомизированной отмены.
Анализ основного критерия эффективности — времени (количество дней) до рецидива в течение 24 недель периода рандомизированной отмены при применении гофликицепта в сравнении с плацебо у пациентов с идиопатическим рецидивирующим перикардитом показал, что применение гофликицепта позволяет контролировать заболевание и статистически значимо снижает риск рецидивов. На протяжении 24 недель наблюдения не было зарегистрировано ни одного рецидива в группе гофликицепта, при этом в группе плацебо рецидив был зарегистрирован у 9 из 10 пациентов.
На фоне терапии гофликицептом было показано снижение интенсивности боли в грудной клетке, уровня С-реактивного белка, а также уменьшение размера перикардиального выпота.
Фармакокинетика
Абсорбция
После однократного подкожного введения гофликицепта в дозе 80 и 160 мг здоровым добровольцам средние значения максимальной концентрации (Cmax) составили 5120±1410 и 10300±4470 нг/мл, соответственно. Максимальная концентрация достигалась в течение 4-5 дней.
После однократного подкожного введения гофликицепта в дозе 80 до 160 мг пациентам с острым приступом подагры значения максимальной концентрации (Cmax) составили, 4930±886 и 10200±3350 нг/мл соответственно Параметры показателей фармакокинетики, полученные в исследовании 1 фазы у здоровых добровольцев, подтвердились в исследовании 2a фазы однократного подкожного применения гофликицепта для лечения острого приступа подагры: в целом наблюдалось дозозависимое увеличение Cmax и AUC гофликицепта,
В исследовании многократного введения в гофликицепта для лечения идиопатического рецидивирующего перикардита пациенты были распределены в две группы:
Группа 1: пациенты, получавшие дозировку 80 мг раз в 2 недели, начиная с Визита 1 в течение 36 недель, число пациентов-4
Группа 2: пациенты со стартовой дозой 160 мг на визите 1, 80 мг — на визите 3, 80 мг — на визите 4, далее — 80 мг каждые 2 недели в течение 36 недель, число пациентов — 6
При многократном введении гофликицепта в дозе 80 мг раз в 2 недели усреднённые значения (Mean±SD) фармакокинетических параметров максимальной, минимальной и средней концентрации (Cmax through, Cmin through и С average through) гофликицепта составили 3925,71± 1698,54 нг/мл, 1148,11± 653,21 нг/мл и 2536,91± 1130,44 нг/мл соответственно. Значение медианы времени достижения максимальной концентрации (Tmax through 1848 часов (между 70 и 84 днем). Значение площади под кривой «концентрация лекарственного вещества — время» в пределах интервала дозирования τ при многократном введении лекарственного средства (AUCτ through) составило 16735361,91±7332863,94 нг*ч/мл.
При многократном введении гофликицепта со стартовой дозой 160 мг, 80 мг в день 7, 80 мг в День 14 и далее 80 мг каждые 2 недели усреднённые значения (Mean±SD) фармакокинетических параметров максимальной, минимальной и средней концентрации (Cmax through, Cmin through и С average through) гофликицепта составили 6574,87±3603,33 нг/мл, 1777,95±748,11 нг/мл и 4176,41±1900,31 нг/мл соответственно. Значение медианы времени достижения максимальной концентрации (Tmax through) составило 336 часов (день 14). Значение площади под кривой «концентрация лекарственного вещества — время» в пределах интервала дозирования τ при многократном введении лекарственного средства (AUCτ through) составило 18627643,79±6630768,40 нг*ч/мл.
Значения фармакокинетических параметров гофликицепта в равновесном (стационарном) состоянии:
При многократном введении гофликицепта в дозе 80 мг раз в 2 недели стационарное (равновесное) состояние достигается к 70 дню (Tmax ss =1680 часов [10 недель]). Значения фармакокинетических параметров максимальной, минимальной и средней концентрации в равновесном состоянии (Cmax ss, Cmin ss и С ss) гофликицепта составили 4018,20 нг/мл, 2549,77 нг/мл и 3283,99 нг/мл соответственно. Значение суммарной площади под кривой «концентрация лекарственного вещества — время» в пределах интервала дозирования (τ) в равновесном состоянии при многократном введении лекарственного средства (AUCτ ss) составило 12151163,87 нг*ч/мл.
При многократном введении гофликицепта со стартовой дозой 160 мг, 80 мг в день 7, 80 мг в День 14 и далее 80 мг каждые 2 недели стационарное (равновесное) состояние достигается к 84 дню (Tmax ss = 2016 часов [12 недель]). Значения фармакокинетических параметров максимальной, минимальной и средней концентрации в равновесном состоянии (Cmax ss, Cmin ss и С ss) гофликицепта составили 3201,40 нг/мл, 2044,56 нг/мл и 2622,98 нг/мл соответственно. Значение суммарной площади под кривой «концентрация лекарственного вещества — время» в пределах интервала дозирования (τ) в равновесном состоянии при многократном введении лекарственного средства (AUCτ ss) составило 11948382,00 нг*ч/мл.
Распределение
Распределение препарата не изучалось.
Биотрансформация
Гофликицепт состоит из аминокислот и углеводов, как природный иммуноглобулин, и поэтому маловероятно его выведение через печеночные пути метаболизма. Поэтому предполагается, что выведение препарата происходит стандартными путями расщепления иммуноглобулинов, результатом которых является распад до малых пептидов и отдельных аминокислот.
Элиминация
Период полувыведения в исследованиях у здоровых добровольцев и пациентов с острым приступом подагры составлял 10 дней.
Линейность (нелинейность)
Результаты исследования фармакокинетики гофликицепта при однократном подкожном введении от 4 до 160 мг (включительно) у здоровых добровольцев продемонстрировали линейное и дозозависимое увеличение значений (Cmax) и площади под кривой зависимости концентрации в плазме от времени (AUC0-t).
Данные доклинической безопасности
Канцерогенность
Исследования канцерогенности не проводились. Исследования токсичности многократного применения, а также механизм действия препарата не указывают на возможность канцерогенного действия. Согласно литературным данным, исследования с использованием мышиной модели ксенографтов опухолей продемонстрировали, что блокада рецептора ИЛ-1 уменьшает рост опухоли, подавляет ангиогенез и развитие метастазов.
Репродуктивная токсичность и негативное влияние на развитие
В 26-недельном исследовании токсичности многократного введения яванским макакам (единственному виду, релевантному для фармакологических исследований) возможное влияние на фертильность самцов и самок изучали с помощью анализа гормонов или менструального цикла, оценки состояния яичек или спермограммы и репродуктивных органов (масса органов и гистопатологическая картина) у половозрелых животных. Никакого влияния гофликицепта ни на один из этих параметров не обнаружено.
Отдельные исследования влияния гофликицепта на сперматогенез, способность к спариванию, также его эмбриотоксического и фетотоксического действия не проводились. Учитывая быстрое и значительное образование антител к препарату у яванских макак, которое было продемонстрировано в 26-недельном исследовании токсичности многократного введения, и обширные ветеринарные вмешательства, необходимые для лечения инфекций, вызванных иммуносупрессивным действием гофликицепта, проведение углубленного исследования влияния препарата на пре- и постнатальное развитие у обезьян не представляется уместным.
Показания
Патогенетическая терапия идиопатического рецидивирующего перикардита у пациентов 18 лет и старше.
Противопоказания
- Гиперчувствительность к гофликицепту или к любому из вспомогательных веществ.
- Тяжелые и/или острые инфекции.
- Беременность.
- Период грудного вскармливания.
Способ применения и дозы
Режим дозирования
Начинать лечение препаратом Арцерикс и наблюдать за ходом лечения разрешается врачам, имеющим опыт в диагностике и лечении идиопатического рецидивирующего перикардита.
Рекомендуется применять:
Нагрузочный режим: в дозе 160 мг (однократно – День 0) с последующими введениями в дозе 80 мг в День 7, День 14 подкожно;
Поддерживающий режим: в дозе 80 мг 1 раз в 2 недели подкожно.
Длительность терапии
Длительность применения препарата Арцерикс определяется индивидуально.
Пропуск дозы
При пропуске дозы во время нагрузочно-индукционного режима:
Если была пропущена инъекция 80 мг в День 7, необходимо проинструктировать пациента ввести 80 мг как можно быстрее в течение последующих 7-ми дней, затем 80 мг в День 14 от первого введения, и далее проводить последующие инъекции по 80 мг каждые 2 недели.
При пропуске дозы во время поддерживающего режима:
Если была пропущена доза 80 мг при поддерживающем режиме (80 мг каждые 2 недели), необходимо ввести пропущенную дозу как только пациент вспомнит об этом, затем проводить введение последующих доз согласно первичному плану лечения.
Прекращение применения препарата
Терапию препаратом Арцерикс следует отменить, если у пациента наблюдается:
- Повышение биохимических показателей функции печени, соответствующее следующим условиям:
‒ Повышение активности АЛТ и/или АСТ более чем в 8 раз от верхней границы нормы.
‒ Повышение активности АЛТ и/или АСТ более чем в 5 раз от верхней границы нормы в течение 2 последовательных недель.
‒ Повышение активности АЛТ и/или АСТ более чем в 3 раза от верхней границы нормы в сочетании с повышением уровня билирубина более чем в 2 раза от верхней границы нормы.
‒ Повышение активности АЛТ и/или АСТ более чем в 3 раза от верхней границы нормы в сочетании с желтухой, слабостью, тошнотой, рвотой, болью/тяжестью в подреберье, повышенной температурой, появлением сыпи, и/или эозинофилией.
- У пациента наблюдаются любые из перечисленных ниже лабораторных отклонений:
‒ Абсолютное количество нейтрофилов <500×106/л (<500 /мм3).
‒ Количество тромбоцитов <50×109/л (<50000 /мм3 или <50000×106/л).
‒ Количество лимфоцитов по результатам двух последовательных анализов <500×106/л (<500 /мм3).
- Подтвержденная беременность во время терапии препаратом Арцерикс
- Тяжелая или угрожающая жизни инфекция.
Особые группы пациентов
Пациенты пожилого возраста (> 65 лет)
Коррекция дозы не требуется.
Пациенты с нарушением функции почек
Коррекция дозы не требуется.
Безопасность и эффективность препарата Арцерикс у пациентов с почечной недостаточностью не изучалась. Данные по применению отсутствуют.
Пациенты с нарушением функции печени
Безопасность и эффективность препарата Арцерикс у пациентов с печеночной недостаточностью не изучалась. Данные по применению отсутствуют.
Коррекция дозы не требуется.
Дети
Безопасность и эффективность препарата Арцерикс у детей и подростков младше 18 лет на данный момент не установлены. Данные по применению отсутствуют.
Способ применения
Препарат Арцерикс вводят подкожно в область передней брюшной стенки. Разрешается чередовать места инъекции с другой областью, приемлемой для выполнения подкожной инъекции: наружная поверхность плеча, передняя поверхность бедра, либо другая область с хорошо развитым подкожно-жировым слоем. В одно место инъекции необходимо вводить не более 2 мл препарата. При введении препарата в дозе 160 мг (4 мл) выполняется две инъекции по 2 мл в разные места введения.
Первое применение препарата проводят под контролем квалифицированного медицинского сотрудника в медицинском центре. После 3 первых последовательных введений Арцерикса (т.е. полная доза, включая одну инъекцию для дозы 80 мг и две инъекции для дозы 160 мг) при нагрузочно-индукционном режиме следует наблюдать за состоянием пациента в течение 1 часа. После обучения технике выполнения подкожных инъекций под контролем медицинского сотрудника пациент (или лицо, осуществляющее за ним уход) может вводить препарат самостоятельно. Решение о возможности самостоятельного введения препарата Арцерикс пациентом принимает врач,
Предостережения, контроль терапии
Особые указания и меры предосторожности при применении
Серьезные инфекции
Блокада интерлейкина-1 (ИЛ-1) может влиять на иммунный ответ на инфекции, в связи с чем у пациентов, получающих иммуносупрессивные препараты, такие как ингибиторы ИЛ1, отмечается более высокая частота инфекций.
Следует проводить медицинское наблюдение пациентов для выявления симптомов инфекций, развивающихся на фоне лечения препаратом Арцерикс.
Лечение препаратом Арцерикс не следует начинать у пациентов с активными инфекциями, в том числе локализованными. Препарат Арцерикс следует с осторожностью принимать у пациентов с повышенным риском развития инфекций, в том числе:
- С тяжелыми или оппортунистическими инфекциями в анамнезе;
- У пациентов пожилого возраста;
- У пациентов, которым проводится терапия иммуносупрессивными препаратами;
- У пациентов с сахарным диабетом; астмой
- У пациентов с почечной недостаточностью;
- У пациентов, злоупотребляющих алкоголем;
- У пациентов с ВИЧ инфекцией;
- У пациентов с иммунодефицитом.
При применении ингибиторов ИЛ-1 может возрастать риск развития туберкулёзной инфекции. Перед началом терапии и во время лечения препаратом Арцерикс необходимо проводить обследование пациента на наличие туберкулезной инфекции, в том числе ее латентной формы. При выявлении туберкулезной инфекции не следует начинать или продолжать лечение препаратом Арцерикс.
При развитии серьезных инфекций терапию препаратом Арцерикс следует прекратить. Серьезные инфекции, которые были зарегистрированы на фоне лечения гофликицептом, включали пневмонию и сепсис. Пациентов, принимающих препарат Арцерикс, следует проинструктировать о возможных признаках и симптомах развития инфекции, требующих немедленного обращения к врачу.
Риск развития злокачественных новообразований
Влияние терапии препаратом Арцерикс на развитие злокачественных новообразований неизвестно. Однако применение иммунодепрессантов потенциально может способствовать повышению риска развития злокачественных новообразований.
Реакции гиперчувствительности
Препарат Арцерикс является лекарственным средством белковой природы. Применение препаратов, содержащих белки, может быть связано с развитием иммунных/аллергических или неиммунных лекарственных реакций гиперчувствительности, которые могут оказаться тяжелыми. Эти реакции могут проявляться как острые реакции на введение препарата, реакции гиперчувствительности немедленного и замедленного типов. Чтобы минимизировать такой риск, по меньшей мере, 3 первых последовательных введения препарата (т.е. полная доза, включая одну инъекцию для дозы 80 мг и две инъекции для дозы 160 мг) должны выполняться только медицинским персоналом в медицинских учреждениях с наличием препаратов и оборудования для обеспечения лечения анафилактических и анафилактоидных реакций.
Нарушение функции печени
В ходе клинических исследований препарата Арцерикс регистрировались нарушения со стороны печени. Большинство нарушений были представлены отклонением от нормы показателей функции печени, чаще всего — трансаминаз (АЛТ и АСТ). У двух пациентов был зарегистрирован острый гепатит, расцененный исследователями как лекарственноиндуцированный (средней степени тяжести и тяжелый). Случай тяжелого гепатита был зарегистрирован в исследуемой популяции с острым приступом подагры у пациента с выраженным обострением панкреатита. Лекарственный генез гепатита в этом случае точно не установлен. Второй случай гепатита не имел клинических симптомов, кроме повышения уровня трансаминаз более чем в 3 раза от верхней границы нормы, и наблюдался у пациента с тяжелым течением COVID-19. В обоих случаях исход был благоприятный.
Следует контролировать активность АЛТ и АСТ в течение 4 недель после начала терапии и затем каждые три месяца в ходе лечения. При необходимости для оценки функции печени следует провести дополнительное обследование.
Гематологические показатели
На фоне применения ингибиторов ИЛ-1 часто отмечалось развитие нейтропении. Оценку показателей крови следует провести до начала терапии, затем проводить через 8-12 недель после начала терапии и далее при необходимости в зависимости от клинических показаний.
Липиды крови
Показатели липидного профиля следует оценить через 4-8 недель после начала терапии, и затем при необходимости в зависимости от клинических показаний.
Вакцинация
Нет данных о риске вторичной передачи инфекции живыми (аттенуированными) вакцинами у пациентов, получающих гофликицепт. В связи с отсутствием данных живые вакцины не следует вводить одновременно с препаратом Арцерикс. Перед началом терапии рекомендуется пройти вакцинацию, в соответствии с национальными рекомендациями, включая пневмококковую вакцину и инактивированную вакцину против гриппа.
Иммуногенность
В ходе клинического изучения препарата антитела к гофликицепту были выявлены у 3 из 22 пациентов (13,6%). У одного пациента в подготовительном периоде наличие антител к препарату отмечено со снижением концентрации препарата в крови. Клиническое значение появления антител неизвестно.
Вспомогательные вещества
Данный препарат содержит менее 1 ммоль (23 мг) натрия на один флакон, то есть по сути не содержит натрия.
Фертильность, беременность и лактация
Женщины детородного возраста (контрацепция)
Исследования влияния гофликицепта на эмбриогенез не проводились.
Перед назначением препарата Арцерикс женщинам детородного возраста следует выполнить тест на беременность. Лечащий врач должен подробно проинструктировать пациентку, способную к деторождению, о необходимости использования высокоэффективных методов контрацепции и выполнения регулярных тестов на беременность во время лечения и в течение по крайней мере 2 месяцев после получения последней дозы препарата Арцерикс.
Беременность
Данные о применении препарата Арцерикс в период беременности отсутствуют. Риски для плода и матери неизвестны. Применение гофликицепта при беременности не рекомендуется. В случае, если пациентка, получающая препарат Арцерикс, забеременеет, она должна немедленно прекратить применение препарата и обратиться к врачу.
Лактация
Неизвестно, проникает ли гофликицепт в грудное молоко. Клинические данные о риске для ребенка, находящегося на грудном вскармливании, отсутствуют. Применение препарата в период грудного вскармливания не рекомендуется.
Фертильность
Клинические данные о влиянии гофликицепта на фертильность у человека отсутствуют.
Влияние на способность управлять транспортными средствами и работать с механизмами
Исследования по изучению влияния препарата на способность управлять транспортными средствами и механизмами не проводились. Пациентам, у которых во время терапии препаратом Арцерикс возникает головокружение, следует воздержаться от управления транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата и другие манипуляции с препаратом
Инструкция по подготовке к инъекции и введению препарата
Извлеките флакон с препаратом Арцерикс из холодильника заранее: следует подождать примерно 30 минут перед инъекцией, чтобы препарат нагрелся до комнатной температуры. Не подогревайте препарат.
Подготовьтесь к инъекции
Шаг 1
Вымойте руки теплой водой с мылом, выберите ровную чистую поверхность, внимательно осмотрите флакон с препаратом и не используйте его, если:
- он был извлечен из холодильника более 4 часов назад,
- на нем указано неправильное название препарата,
- истек срок годности, указанный на упаковке,
- на флаконе имеются трещины, повреждения или утечка препарата, раствор мутный, изменил цвет или содержит хлопья, или частицы.
Подготовьте препарат к применению следуя инструкции.
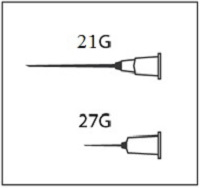
Приготовьте одноразовый шприц для подкожных инъекций вместимостью 3 мл, две одноразовых стерильных инъекционных иглы (рекомендуется использовать иглу размера 21G для набора препарата из флакона и иглу 27G для выполнения подкожной инъекции), 2 салфетки стерильные спиртовые.
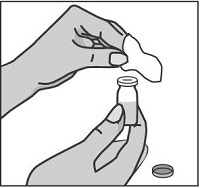
Шаг 2
Наденьте на шприц более толстую иглу для набора препарата, не снимая защитный колпачок. Удалите пластмассовую защитную крышку с флакона, протрите резиновую пробку стерильной спиртовой салфеткой.
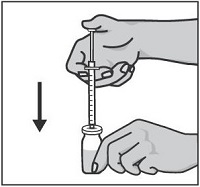
Возьмите шприц в правую руку, удалите колпачок с иглы шприца и введите иглу вертикально в центр пробки флакона так, чтобы кончик иглы появился с внутренней стороны пробки.
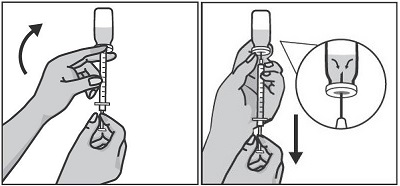
Удерживая правой рукой шприц, возьмите левой рукой флакон и переверните его так, чтобы вся жидкость собралась над пробкой. Оттягивая поршень шприца вниз, наберите в шприц все содержимое флакона.
Вытащите иглу из флакона и закройте колпачком. Не снимая защитный колпачок, замените на иглу для подкожных инъекций. Использованную иглу для набора препарата выбросьте в контейнер для острых предметов.
Внимание! Не выполняйте инъекцию иглой для набора препарата, это может привести к боли и повреждениям в месте инъекции.
Шаг 3
Осторожно снимите колпачок с иглы для подкожных инъекций. Не прикасайтесь к ней и соблюдайте осторожность чтобы не уколоться кончиком иглы. Удерживайте шприц вертикально и постучите по нему пальцем, чтобы пузырьки воздуха поднялись вверх. Удерживая шприц вертикально, медленно сдвиньте поршень, чтобы изгнать из шприца воздух и избыточный объем жидкости так, чтобы поршень шприца остановился на отметке 2 мл.
Поместите шприц на картонную коробку таким образом, чтобы игла оставалась сверху упаковки и не касалась других поверхностей.
Выберите место для инъекции
Выберите место инъекции на верхней части бедра или на животе на расстоянии не менее 5 см от пупка. Если инъекции делает медицинский работник, то препарат можно вводить в другие места для подкожных инъекций. Не рекомендуется введение препарата в места родинок, шрамов, повреждений или уплотнений, покраснений, повышенной чувствительности кожных покровов.
Рекомендуется регулярно менять место введения препарата. Новое место для инъекции должно находиться на расстоянии не менее 2,5 см от предыдущего места инъекции. При желании можно поочередно выполнять инъекции под кожу бедер и живота.
Выполните инъекцию
Протрите кожу выбранного места инъекции новой стерильной спиртовой салфеткой. Позвольте месту инъекции высохнуть и не прикасайтесь к нему до инъекции.
Осторожно сожмите кожу вокруг обработанного места инъекции второстепенной рукой (например, если Вы правша, используйте левую руку) и плотно удерживайте ее.
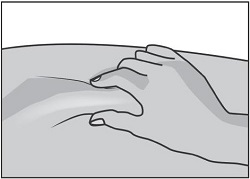
Удерживайте шприц в ведущей руке над приподнятым участком кожи под углом 90 градусов. Воткните иглу в кожу быстрым плавным толкающим движением. Если количество подкожного жира на брюшной стенке невелико, можно выполнять инъекцию под углом 45 градусов.
Не смещайте иглу относительно тканей и медленно нажимайте на поршень, пока весь объем препарата из шприца не будет введен под кожу. Поршень должен достичь дна шприца. Подождите несколько секунд перед извлечением иглы.
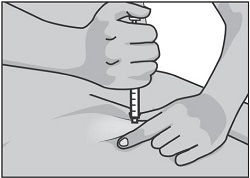
Извлеките иглу из кожи под тем же углом, под которым она была введена. В месте инъекции возможно небольшое кровотечение. При необходимости приложите стерильную салфетку на место инъекции.
Помните!
Выбрасывайте использованные шприцы в контейнер для острых предметов сразу после инъекции. Когда контейнер будет заполнен полностью, аккуратно и тщательно закройте его и выкиньте в мусорное ведро.
Всегда используйте новый шприц, не используйте повторно старые шприцы.
Весь неиспользованный остаток лекарственного средства или отходы подлежат утилизации в соответствии с местными нормативными требованиями.
Побочные эффекты
Резюме профиля безопасности
Большинство нежелательных явлений в клинических исследованиях были представлены повышением активности трансаминаз (АЛТ — 7,2%, АСТ — 5,8%), головной болью (6,3%), реакциями в месте инъекции (4,3%). Большинство этих явлений были легкой или средней степени тяжести, кроме повышения трансаминаз тяжелой степени у одного пациента.
Перечень нежелательных реакций приведен на основе сводных данных по четырем завершенным клиническим исследованиям (всего 208 участников в группе терапии гофликицептом: 25 здоровых добровольцев, 38 пациентов с острым приступом подагры, 123 пациента с COVID-19 и 22 пациента с идиопатическим рецидивирующим перикардитом).
Табличное резюме нежелательных реакций
Нежелательные реакции представлены в Таблице 1 в соответствии с системно-органными классами MedDRA. В пределах каждого класса нежелательные реакции распределены по категориям частоты встречаемости: часто (от ≥1/100, но <1/10), нечасто (от ≥1/1000, но <1/100).
Ввиду небольшого общего количества пациентов в изученных популяциях, в перечень включены нежелательные явления, встречающиеся с частотой более 1,5%, а также отдельные реакции с меньшей частотой, но высокой степенью причинно-следственной связи с терапией. Таким образом, нежелательные явления, встречающиеся более чем в 3 случаях, включены в графу «часто».
Таблица 1. Нежелательные реакции, зарегистрированные при применении гофликицепта (n=208)
|
Системно-органный класс |
Класс частоты |
|
|
Часто |
Нечасто |
|
|
Инфекции и инвазии |
Назофарингит |
|
|
Нарушения со стороны крови и лимфатической системы |
Анемия |
|
|
Нарушения метаболизма и питания |
Гипергликемия Дислипидемия |
|
|
Нарушения со стороны нервной системы |
Головная боль |
|
|
Желудочно-кишечные нарушения |
Тошнота |
|
|
Нарушения со стороны кожи и подкожных тканей |
Аллергический дерматит |
|
|
Нарушения со стороны мышечной, скелетной и соединительной ткани |
Артралгия |
|
|
Общие нарушения и реакции в месте введения |
Реакции в месте инъекции2 |
|
|
Лабораторные и инструментальные данные |
Повышение активности аланинаминотрансферазы |
|
1. Все, кроме одного, случаи пневмоний и все случаи сепсиса регистрировались в популяции пациентов с тяжелым течением COVID-19.
2. Местные реакции были представлены кровоизлиянием, гиперемией (эритемой), зудом в месте инъекции.
Описание отдельных нежелательных реакций
Инфекции
Большинство инфекций было представлено инфекциями верхних дыхательных путей и инфекцией мочевыводящих путей. Среди тяжелых инфекций были зарегистрированы пневмония, сепсис, септический шок, в том числе с летальными исходами (в популяции пациентов с тяжелым течением COVID-19). Большинство случаев тяжелых инфекций были зарегистрированы в популяции пациентов с тяжелым течением COVID-19.
Сообщения о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза — риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств — членов Евразийского экономического союза
Российская Федерация
109012, Москва, Славянская площадь, д.4, стр.1
Федеральная служба по надзору в сфере здравоохранения
Тел.: +7 800 550 99 03
Электронная почта: pharm@roszdravnadzor.gov.ru
https://roszdravnadzor.gov.ru
Передозировка
О случаях передозировки препаратом Арцерикс не сообщалось. Антидот к гофликицепту неизвестен. В случае передозировки рекомендуется симптоматическая терапия.
Взаимодействие
Специальные клинические исследования лекарственных взаимодействий гофликицепта не проводились.
При применении одного из ингибиторов ИЛ-1 с ингибитором фактора некроза опухоли
(ФНО) отмечалось увеличение частоты развития серьезных инфекций и нейтропении. Применение препарата Арцерикс с ингибиторами ФНО не рекомендовано в связи увеличением риска развития серьезных инфекций. Применение препарата Арцерикс с другими блокаторами ИЛ-1 не изучалось, поэтому совместное применение не рекомендовано.
Предполагается, что, ингибируя ИЛ-1, препарат Арцерикс будет подавлять ИЛ-6опосредованное ингибирование выработки ферментов CYP или транспортных белков, таких как ферменты CYP1A1/2, 2B6, 2C9, 3A4/5, 2C19 и Na-таурохолат котранспортирующий полипептид (NTCP). Снижение супрессии выработки ферментов CYP или транспортных белков может привести к снижению уровня препаратов, метаболизируемых этими ферментами. Такое снижение может иметь клиническое значение при применении препаратов – субстратов CYP450 с узким терапевтическим диапазоном, доза которых корректируется на индивидуальной основе (например, варфарина). Таким образом, применение гофликицепта может приводить к изменению системных концентраций и/или эффекта сопутствующих препаратов, которые метаболизируются с участием ферментов CYP и/или NTCP. Эти препараты включают (но не ограничиваются перечисленным) определенные статины (то есть ингибиторы 3-гидрокси-3-метилглутарилкоэнзим А редуктазы), блокаторы кальциевых каналов, пероральные контрацептивы, бензодиазепины, а также теофиллин, варфарин, фенитоин и циклоспорин. Соответственно, при терапии препаратом Арцерикс следует уделять пристальное внимание эффективности или токсичности, применяемых пациентом сопутствующих лекарственных препаратов, которые, по имеющимся данным, метаболизируются/выводятся с участием CYP1A1/2, 2B6, 2C9, 2C19, 3A4/5 и NTCP; кроме того, может потребоваться коррекция дозы сопутствующих лекарственных препаратов
Условия и сроки хранения
Срок годности
2 года
Особые меры предосторожности при хранении
Хранить при температуре от 2 до 8°C в оригинальной упаковке (пачке картонной).

Приведенная научная информация, содержащая описание активных веществ лекарственных препаратов, является обобщающей. Содержащаяся на сайте информация не должна быть использована для принятия самостоятельного решения о возможности применения представленных лекарственных препаратов и не может служить заменой очной консультации врача.
