Фабхальта®
Состав
Каждая капсула содержит 200 мг иптакопана (в виде иптакопана гидрохлорида моногидрата).
Оболочка капсулы:
- Желатин
- Титана диоксид (E171)
- Краситель железа оксид желтый (E172) Краситель железа оксид красный (E172) Чернила для печати:
- Шеллак (E904)
- Краситель железа оксид черный (E172) Пропиленгликоль (E1520)
- Аммиака раствор концентрированный (E527) Калия гидроксид (E525)
Характер и содержание первичной упаковки
- По 14 капсул в блистер из поливинилхлорида (ПВХ)/полиэтилена (ПЭ)/поливинилиденхлорида (ПВДХ) и алюминиевой фольги.
- По 4 блистера вместе с листком-вкладышем в картонную пачку. Допускается наличие контроля первого вскрытия на картонной пачке.
Лекарственная форма
Капсулы
Твёрдые, непрозрачные капсулы размером № 0 светло-желтого цвета. На корпусе черными чернилами нанесена маркировка «LNP200», на крышечке — черными чернилами нанесена маркировка «NVR».
Содержимое капсулы: порошок от белого или почти белого цвета до светло фиолетово-розового цвета.
Фармакодинамика
Фармакотерапевтическая группа: иммунодепрессанты; ингибиторы комплемента.
Механизм действия
Иптакопан представляет собой ингибитор проксимальной части каскада комплемента, действие которого направлено на фактор B (FB) с селективным ингибированием альтернативного пути активации комплемента без влияния на лектиновый и классический пути. Ингибирование фактора B подавляет активность С3-конвертазы альтернативного пути и последующее формирование C5-конвертазы.
При ПНГ внутрисосудистый гемолиз опосредован реакциями мембраноатакующего комплекса (МАК), тогда как внесосудистый гемолиз связан с опсонизацией C3 компонентом. Иптакопан воздействует на проксимальное звено альтернативного пути каскада комплемента, блокируя как C3-опосредованный внесосудистый гемолиз так и опосредованный терминальной стадией каскада комплемента внутрисосудистый гемолиз. Фармакодинамические эффекты
Начало ингибирования биомаркеров альтернативного пути комплемента, определенное в ex vivo исследованиях альтернативного пути, и уровня Bb (фрагмент Bb фактора B) в плазме крови, отмечалось через ≤ 2 часа после применения однократной дозы иптакопана у здоровых добровольцев.
У пациентов с ПНГ, получавших одновременно ингибитор С5 и иптакопан в дозе 200 мг два раза в сутки, показатели ex vivo исследования альтернативного пути и уровень Bb в плазме крови снизились по сравнению с исходными значениями на 54,1 % и 56,1 % соответственно при первом наблюдении в день 8. У пациентов с ПНГ, ранее не получавших лечение, при первом наблюдении после 4 недель применения иптакопана в дозе 200 мг два раза в сутки обнаруживали снижение данных биомаркеров по сравнению с исходным уровнем на 78,4 % и 58,9 % соответственно.
У пациентов с ПНГ, получавших одновременно ингибитор С5 и иптакопан в дозе 200 мг два раза в сутки, среднее значение размера клона ПНГ-эритроцитов (ПНГ-клона) исходно составило 54,8 % и увеличилось до 89,2 % через 13 недель; доля ПНГ-эритроцитов II + III типов с отложениями фрагмента C3 исходно составила 12,4 % и снизилась до 0,2 % через 13 недель. У пациентов с ПНГ, ранее не получавших лечение, среднее значение размера ПНГ-клона исходно составило 49,1 % и увеличилось до 91,1 % через 12 недель; в этой популяции пациентов в связи с преобладанием внутрисосудистого гемолиза отмечалось незначительное число ПНГ-эритроцитов II + III типов с отложениями фрагмента C3.
Иптакопан снижает активность ЛДГ в сыворотке крови. У всех пациентов с ПНГ, ранее получавших экулизумаб, после применения иптакопана в дозе 200 мг два раза в сутки, через 13 недель отмечалось снижение активности ЛДГ до значений < 1,5 × верхней границы нормы (ВГН). Данный эффект сохранялся вплоть до окончания исследования. У пациентов с ПНГ, ранее не получавших лечение, применение иптакопана в дозе 200 мг два раза в сутки обеспечивало снижение активности ЛДГ на > 60 % от исходного после 12 недель терапии, что сохранялось до окончания исследования.
Влияние на электрофизиологию сердца
В клиническом исследовании по оценке интервала QTc у здоровых добровольцев однократное применение супратерапевтических доз иптакопана до 1200 мг (что более чем в 4 раза превышает пиковую концентрацию при МРДЧ) не оказывало влияния на реполяризацию сердца и интервал QT.
Клиническая эффективность и безопасность
Эффективность и безопасность препарата Фабхальта у взрослых пациентов с ПНГ оценивали в двух 24-недельных многоцентровых открытых исследованиях 3 фазы: исследовании с активным контролем (APPLY-PNH; NCT04558918) и несравнительном исследовании (APPOINT-PNH; NCT04820530).
APPLY-PNH: пациенты с ПНГ, ранее получавшие лечение ингибитором C5
В исследовании APPLY-PNH принимали участие пациенты с ПНГ и резидуальной анемией (концентрация гемоглобина < 10 г/дл), отмечавшейся несмотря на предшествующее лечение ингибитором C5 (экулизумабом либо равулизумабом) в стабильном режиме в течение минимум 6 месяцев до рандомизации.
Девяносто семь пациентов были рандомизированы в соотношении 8:5 в две группы: применения препарата Фабхальта в дозе 200 мг внутрь два раза в сутки (n = 62) или продолжения лечения ингибиторами C5 (экулизумабом, n = 23 или равулизумабом, n = 12) на протяжении 24-недельного рандомизированного контрольного периода (РКП). Рандомизация была стратифицирована на основании предшествующего лечения ингибиторами C5 и наличия в анамнезе трансфузий в течение последних 6 месяцев. После завершения 24-недельного РКП все пациенты соответствовали критериям включения в 24- недельный период продолжения терапии и могли получать монотерапию препаратом Фабхальта. Впоследствии пациенты допускались к участию в отдельном исследовании долгосрочного продолжения терапии.
Пациенты должны были пройти вакцинацию против Neisseria meningitidis, также им была рекомендована вакцинация против Streptococcus pneumoniae и Haemophilus influenzae типа b. Если пациент ранее не был вакцинирован или нуждался в ревакцинации, ее проводили по меньшей мере за 2 недели до получения первой дозы препарата. Если лечение препаратом Фабхальта начиналось ранее чем через 2 недели после вакцинации, проводили профилактический курс антибактериальной терапии.
Демографические данные и исходные характеристики заболевания в группах лечения были хорошо сбалансированы (см. таблицу 2). Средняя продолжительность предшествующей терапии ингибиторами C5 составила 3,8 и 4,2 года в группе препарата Фабхальта и группе ингибиторов C5 соответственно. Исходное среднее значение размеров ПНГ-клона (II + III типы) составило 64,6 % в группе препарата Фабхальта и 57,4 % в группе ингибиторов C5. Среднее значение исходной концентрации гемоглобина составило 8,9 г/дл в обеих группах. В течение 6 месяцев, предшествующих рандомизации, трансфузия требовалась приблизительно 57 % и 60 % пациентов в группах препарата Фабхальта и ингибиторов C5 соответственно. Среднее значение исходной активности ЛДГ составило 269,1 Ед/л в группе препарата Фабхальта и 272,7 Ед/л в группе ингибиторов С5. Большие нежелательные сосудистые события (MAVE) отмечались в анамнезе у 19,4 % и 28,6 % участников, получавших препарат Фабхальта и ингибиторы C5, соответственно.
В течение РКП одна участница в группе препарата Фабхальта досрочно прекратила терапию в связи с наступлением беременности; в группе ингибиторов C5 не было участников, досрочно прекративших лечение.
Таблица 2. Исходные демографические данные и характеристики пациентов в APPLY-PNH
|
Параметры |
Статистический показатель |
Препарат Фабхальта (n = 62) |
Ингибиторы С5 (n = 35) |
|
Возраст (годы) |
Среднее значение (SD) |
51,7 (16,9) |
49,8 (16,7) |
|
мин., макс. |
22, 84 |
20, 82 |
|
|
Пол |
n (%) |
43 (69,4) |
24 (68,6) |
|
Женский |
|||
|
Раса |
n (%) |
12 (19,4) |
7 (20,0) |
|
Монголоидная |
|||
|
Негроидная или афроамериканцы |
n (%) |
2 (3,2) |
2 (5,7) |
|
Европеоидная |
n (%) |
48 (77,4) |
26 (74,3) |
|
Этническая принадлежность |
|||
|
Латиноамериканцы |
n (%) |
8 (12,9) |
2 (5,7) |
|
Не латиноамериканцы |
n (%) |
51 (82,3) |
27 (77,1) |
|
Не сообщалась/неизвестна |
n (%) |
3 (4,8) |
6 (17,1) |
|
Концентрация гемоглобина (г/дл) |
Среднее значение (SD) |
8,9 (0,7) |
8,9 (0,9) |
|
Активность ЛДГ (Ед/л) |
Среднее значение (SD) |
269,1 (70,1) |
272,7 (84,8) |
|
Абсолютное количество ретикулоцитов (АКР) (109/л) |
Среднее значение (SD) |
193,2 (83,6) |
190,6 (80,9) |
|
По меньшей мере одна трансфузия в период 12 месяцев до скрининга |
n (%) |
37 (59,7) |
22 (62,9) |
|
По меньшей мере одна трансфузия в период 6 месяцев до рандомизации |
n (%) |
35 (56,5) |
21 (60,0) |
|
Количество трансфузий в течение 6 месяцев до рандомизации среди пациентов, получавших трансфузии |
Среднее значение (SD) |
3,1 (2,6) |
4,0 (4,3) |
|
Анамнез MAVE (включая тромбоз) в последние 12 месяцев |
n (%) |
12 (19,4) |
10 (28,6) |
|
Длительность заболевания (годы) |
Среднее значение (SD) |
11,9 (9,8) |
13,5 (10,9) |
|
Сокращения: ЛДГ: лактатдегидрогеназа; MAVE: большие нежелательные сосудистые события; SD: стандартное отклонение |
|||
Анализ эффективности основывался на двух первичных конечных точках с целью демонстрации превосходства препарата Фабхальта над ингибиторами C5 в отношении достижения гематологического ответа после 24 недель терапии без необходимости проведения трансфузий. Оценка определялась долей участников, у которых отмечались: 1) устойчивое повышение концентрации гемоглобина на ≥ 2 г/дл по сравнению с исходным уровнем (увеличение концентрации гемоглобина) и/или 2) стабильная концентрация гемоглобина ≥ 12 г/дл. Вторичные конечные точки включали отсутствие необходимости трансфузий, изменение концентрации гемоглобина относительно исходной, изменение балла по шкале функциональной оценки терапии хронических заболеваний по показателю утомляемости (FACIT-Fatigue), развитие «прорывного» гемолиза с клиническими проявлениями и изменение абсолютного количества ретикулоцитов относительно исходного.
Препарат Фабхальта обладал превосходством над ингибиторами C5 со статистически достоверным различием в частоте ответа, составлявшем 80,2 % (82,3 % в сравнении с 2 %), в увеличении концентрации гемоглобина (устойчивое повышение концентрации гемоглобина на ≥ 2 г/дл от исходной), при этом разница в количестве пациентов с увеличенной концентрацией составила 67 % (68,8 % в сравнении с 1,8 %), в поддержании устойчивой концентрации гемоглобина ≥ 12 г/дл. В обеих первичных конечных точках не требовалось переливания эритроцитной массы после 24 недель лечения (p < 0,0001) (см. таблицу 3).
В целом в группе, получавшей препарат Фабхальта, у большего числа участников отмечались увеличение концентрации гемоглобина (51/60) и стабильная концентрация гемоглобина ≥12 г/дл (42/60) по сравнению с группой, получавшей ингибиторы C5 (0/35 и 0/35 соответственно), что не сопровождалось необходимостью проведения переливания эритроцитной массы (см. таблицу 3).
Препарат Фабхальта также обладал превосходством над ингибиторами C5 по показателю отсутствия необходимости трансфузий с различием в 68,9 % (94,8 % в сравнении с 25,9 %; p < 0,0001) и по показателю изменения концентрации гемоглобина относительно исходной (различие между группами лечения + 3,66 г/дл; p < 0,0001). Влияние терапии препаратом Фабхальта на концентрацию гемоглобина отмечалось уже на 7 день и сохранялось в течение всего исследования (см. рисунок 1).
Препарат Фабхальта обладал преимуществом перед ингибиторами C5 в снижении утомляемости по оценке по шкале FACIT-Fatigue (различие между группами лечения + 8,29 балла; p < 0,001), при этом в группе, получавшей препарат Фабхальта, отмечалось клинически значимое улучшение показателей утомляемости по данным самостоятельной оценки пациентами (+ 8,59 балла). Препарат Фабхальта также превосходил ингибиторы С5 по показателю годовой частоты «прорывного» гемолиза с клиническими проявлениями (различие между группами лечения 90 %; p < 0,01) и по уменьшению абсолютного количества ретикулоцитов по сравнению с исходным уровнем (различие между группами лечения составило 116,2 × 109/л; p < 0,0001), что согласуется с данными об ингибировании внесосудистого гемолиза.
Соотношение конечной и исходной активности ЛДГ было одинаковым в обеих группах участников, что подтверждает способность препарата Фабхальта к поддержанию контроля внутрисосудистого гемолиза после прекращения лечения ингибиторами C5 (см. таблицу 3).
Таблица 3 Результаты оценки эффективности за 24-недельный период рандомизированного лечения в исследовании APPLY-PNH
|
Конечные точки |
Препарат Фабхальта (N = 62) |
Ингибиторы С5 (N = 35) |
Различие (95 % ДИ), значение p |
|
Первичные конечные точки |
|||
|
Количество пациентов, достигших улучшения значений концентрации гемоглобина (устойчивого повышения |
51/60b |
0/35b |
|
|
Конечные точки концентрации гемоглобина на ≥ 2 г/дл по сравнению с исходнойa при отсутствии трансфузий) |
82,3 |
2,0 |
80,2 (71,2, 87,6) < 0,0001 |
|
Частота ответа на лечениеc (%) |
|||
|
Количество пациентов, достигших стабильной концентрации гемоглобина ≥ 12 г/длa при отсутствии трансфузий |
42/60b |
0/35b |
67,0 (56,4, 76,9) < 0,0001 |
|
Частота ответа на лечениеc (%) |
68,8 |
1,8 |
|
|
Вторичные конечные точки |
|||
|
Количество пациентов без необходимости трансфузийd,e |
59/62b |
14/35b |
68,9 (51,4, 83,9) < 0,0001 |
|
Частота отсутствия необходимости трансфузийc (%) |
94,8 |
25,9 |
|
|
Изменение концентрации гемоглобина относительно исходной (г/дл) (скорректированное среднееf) |
3,60 |
-0,06 |
3,66 (3,20, 4,12) < 0,0001 |
|
Изменение оценки по шкале FACIT-Fatigue от исходного уровня (скорректированное среднееg) |
8,59 |
0,31 |
8,29 (5,28, 11,29) < 0,0001 |
|
«Прорывной» гемолиз с клиническими проявлениямиh,i, % (n/N) |
3,2 (2/62) |
17,1 (6/35) |
|
|
Годовая частота «прорывного» гемолиза с клиническими проявлениями |
0,07 |
0,67 |
ОР = 0,10 (0,02, 0,61) 0,01 |
|
Изменение абсолютного количества ретикулоцитов от исходного уровня (109/л) (скорректированное среднееg) |
-115,8 |
0,3 |
-116,2 (-132,0, -100,3) < 0,0001 |
|
Соотношение конечной и исходной активности ЛДГ (скорректированное среднее геометрическоеg) |
0,96 |
0,98 |
Отношение = 0,99 (0,89, 1,10) 0,84 |
|
MAVEh % (n/N) |
1,6 (1 / 62) |
0 |
|
|
Годовая частота MAVEh |
0,03 |
0 |
0,03 (-0,03, 0,10) 0,32 |
Сокращения: ОР: отношение рисков; ЛДГ: лактатдегидрогеназа; MAVE: большие нежелательные сосудистые события
a. Оценивали в период с дня 126 по день 168.
|
|||
Рисунок 1 Средняя концентрация гемоглобина* (г/дл) в течение 24-недельного периода рандомизированного лечения в исследовании APPLY-PNH
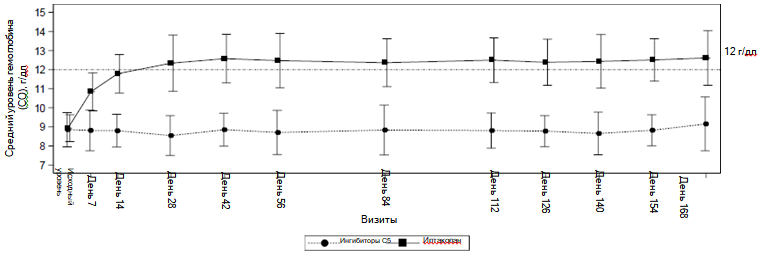
* Примечание: рисунок отображает все результаты измерения концентрации гемоглобина, полученные в данном исследовании, в том числе в течение 30 дней после трансфузии эритроцитной массы.
Результаты в первичных конечных точках были сопоставимыми во всех подгруппах исследования, в т. ч. выделенных на основании продолжительности заболевания, возраста, пола, исходной концентрации гемоглобина, наличия в анамнезе MAVE, предыдущей терапии ингибиторами C5 (экулизумаб или равулизумаб), необходимости проведения трансфузий в течение последних 6 месяцев, количества трансфузий в течение последних 6 месяцев (< 2 или ≥ 2), исходной активности ЛДГ и продолжительности предшествующей терапии ингибиторами С5.
APPOINT-PNH: исследование у пациентов, ранее не получавших лечение ингибиторами комплемента
В исследовании APPOINT-PNH участвовало 40 взрослых пациентов с ПНГ (размер ПНГ- клона ≥ 10 %) с концентрацией гемоглобина < 10 г/дл и активностью ЛДГ в 1,5 раза превышающим ВГН, ранее не получавших ингибиторы комплемента. Все 40 участников получали препарат Фабхальта 200 мг внутрь два раза в сутки на протяжении 24-недельного открытого основного периода лечения. Впоследствии все пациенты соответствовали критериям включения в 24-недельный период продления терапии и могли продолжать получать препарат Фабхальта с последующим участием в отдельном исследовании долгосрочного продолжения терапии.
Пациенты должны были пройти вакцинацию против Neisseria meningitidis, также им была рекомендована вакцинация против Streptococcus pneumoniae и Haemophilus influenzae типа b. Если пациент ранее не был вакцинирован или нуждался в ревакцинации, ее проводили по меньшей мере за 2 недели до или в период 2 недель после получения первой дозы препарата. Если лечение препаратом Фабхальта начиналось ранее чем через 2 недели после вакцинации, проводили профилактический курс антибактериальной терапии.
Таблица 4 демонстрирует демографические данные и исходные характеристики заболевания у пациентов. Ни один из пациентов не прекратил участия в исследовании в основной период лечения.
Таблица 4 Исходные демографические данные и характеристики пациентов в APPOINT-PNH
|
Параметры |
Статистический показатель |
Препарат Фабхальта (n = 40) |
|
Возраст (годы) |
Среднее значение (СО) |
42,1 (15,9) |
|
мин., макс. |
18, 81 |
|
|
Пол |
n (%) |
17 (42,5) |
|
Женский |
||
|
Концентрация гемоглобина (г/дл) |
Среднее значение (СО) |
8,2 (1,1) |
|
Активность ЛДГ (Ед/л) |
Среднее значение (СО) |
1698,8 (683,3) |
|
Абсолютное количество ретикулоцитов (АКР) (109/л) |
Среднее значение (СО) |
154,3 (63,7) |
|
По меньшей мере одна трансфузия в период 12 месяцев до скрининга |
n (%) |
27 (67,5) |
|
По меньшей мере одна трансфузия в период 6 месяцев до лечения |
n (%) |
28 (70,0) |
|
Количество трансфузий в течение 6 месяцев, предшествующих лечению, среди пациентов, получавших трансфузии |
Среднее значение (СО) |
3,1 (2,1) |
|
Анамнез MAVE (включая тромбоз) |
n (%) |
5 (12,5) |
|
Длительность заболевания (годы) |
Среднее значение (СО) |
4,7 (5,5) |
Эффективность оценивалась по влиянию лечения препаратом Фабхальта на долю пациентов, достигших увеличения концентрации гемоглобина (устойчивого повышения концентрации гемоглобина на ≥ 2 г/дл по сравнению с исходной при отсутствии необходимости переливания эритроцитной массы через 24 недели) в первичной конечной точке. Вторичные конечные точки включали: стабильную концентрацию гемоглобина ≥ 12 г/дл (при отсутствии необходимости трансфузий эритроцитной массы) через 24 недели, отсутствие необходимости трансфузий, изменение концентрации гемоглобина относительно исходной, изменение балла по шкале FACIT-Fatigue, развитие «прорывного» гемолиза с клиническими проявлениями и изменение абсолютного количества ретикулоцитов относительно исходного показателя.
Терапия препаратом Фабхальта через 24 недели характеризовалась частотой ответа 92,2 % (95 % ДИ: 82,5, 100,0) в отношении увеличения концентрации гемоглобина при отсутствии необходимости переливания эритроцитной массы. Частота ответа на лечение — достижения концентрации гемоглобина ≥ 12 г/дл без необходимости переливания эритроцитной массы — составляла 62,8 % (95 % ДИ: 47,5, 77,5). Терапия препаратом Фабхальта приводила к снижению потребности в трансфузиях с частотой 97,6 % (95 % ДИ: 92,5, 100,0). У пациентов, получавших препарат Фабхальта, отмечали клинически значимые улучшения значений утомляемости по данным самостоятельной оценки пациентами (изменение значений утомляемости FACIT-Fatigue от исходного уровня + 10,8; 95 % ДИ: 8,7, 12,8). Ни у одного из участников не отмечалось развитие «прорывного» гемолиза с клиническими проявлениями или MAVE. После 24 недель исследования у пациентов, получавших препарат Фабхальта, концентрация гемоглобина увеличилась на 4,3 г/дл (95 % ДИ: 3,9, 4,7), абсолютное количество ретикулоцитов изменилось на 82,5 × 109/л (95 % ДИ: 89,3, 75,6), а активность ЛДГ в процентном отношении снизилась на 83,6 % (95 % ДИ: 84,9, 82,1) по сравнению с исходными значениями. Влияние терапии препаратом Фабхальта на активность ЛДГ отмечалось уже на 7 день и позволяло достичь значений < 1,5 ВГН к дню 14, которые сохранялись в течение всего исследования. (См. таблицу 5 и рисунок 2).
Таблица 5 Результаты оценки эффективности за 24-недельный период основного лечения в исследовании APPOINT-PNH
|
Конечные точки |
Препарат Фабхальта (N = 40) 95 % ДИ |
|
Первичная конечная точка |
|
|
Количество пациентов, достигших увеличения концентрации гемоглобина (устойчивого повышения концентрации гемоглобина на ≥ 2 г/дл по сравнению с исходнойa при отсутствии трансфузий) |
31/33b |
|
Частота ответа на лечениеc (%) |
92,2 (82,5, 100,0)d |
|
Вторичные конечные точки |
|
|
Количество пациентов, достигших стабильной концентрации гемоглобина ≥12 г/длa при отсутствии трансфузий |
19/33b |
|
Частота ответа на лечениеc (%) |
62,8 (47,5, 77,5) |
|
Количество пациентов без необходимости трансфузийe,f |
40/40b |
|
Частота отсутствия необходимости трансфузийc (%) |
97,6 (92,5, 100,0) |
|
Изменение концентрации гемоглобина относительно исходной (г/дл) (скорректированное среднееj) |
+ 4,3 (3,9, 4,7) |
|
Изменение оценки по шкале FACIT-Fatigue от исходного уровня (скорректированное среднееj) |
+ 10,8 (8,7, 12,8) |
|
«Прорывной» гемолиз с клиническими проявлениямиg,h, % (n/N) |
0/40 |
|
Годовая частота «прорывного» гемолиза с клиническими проявлениями |
0,0 (0,0, 0,2) |
|
Изменение абсолютного количества ретикулоцитов от исходного уровня (109/л) (скорректированное среднееj) |
-82,5 (-89,3, -75,6) |
|
Процентное изменение активности ЛДГ от исходного (скорректированное среднееj) |
-83,6 (-84,9, -82,1) |
|
Процент пациентов с MAVEh |
0,0 |
a. Оценивали в период с дня 126 по день 168.
|
|
Рисунок 2 Среднее значение активности ЛДГ (Ед/л) на протяжении 24-недельного основного периода лечения в исследовании APPOINT-PNH
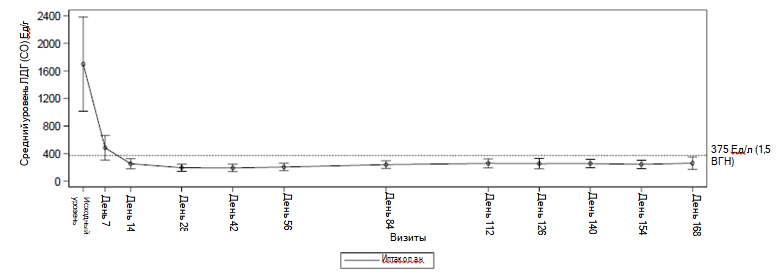
Результаты в первичных конечных точках были сопоставимыми во всех подгруппах исследования, в т. ч. определенных на основании продолжительности заболевания, возраста, пола, исходной концентрации гемоглобина, наличия в анамнезе MAVE, необходимости проведения трансфузий в течение последних 6 месяцев и количества трансфузий в течение последних 6 месяцев (<2 или ≥2).
Исследования 2 фазы
Эффективность препарата Фабхальта у взрослых пациентов с ПНГ была также установлена в двух открытых исследованиях фазы 2 (CLNP023X2201 в качестве дополнения к терапии экулизумабом и CLNP023X2204 в режиме монотерапии), проведенных у 29 пациентов с активным гемолизом, размером ПНГ-клона не менее 10 %, средней концентрацией гемоглобина < 10,5 г/дл и активностью ЛДГ не менее 1,25 ВГН. Пациентам, получавшим препарат Фабхальта в качестве дополнительной терапии в исследовании CLNP023X2201, прекратили введение экулизумаба в ходе исследования и продолжили монотерапию препаратом Фабхальта. Эти 29 пациентов получали монотерапию препаратом Фабхальта в течение до 3,4 лет и у данных пациентов отмечалось устойчивое повышение концентрации гемоглобина и снижение активности ЛДГ на протяжении всего периода лечения.
Фармакокинетика
Абсорбция
При пероральном приеме иптакопана максимальная концентрация в плазме крови достигается примерно через 2 часа. При применении по рекомендованной схеме 200 мг два раза в сутки равновесное состояние достигается примерно через 5 дней при незначительном накоплении (1,4-кратном). В исследовании влияния приема пищи, в ходе которого здоровые добровольцы получали иптакопан натощак либо вместе с пищей с высоким содержанием жиров, получены значения Cmax и AUC, свидетельствующие об отсутствии влияния пищи на экспозицию иптакопана. Таким образом, препарат Фабхальта можно принимать вне зависимости от приема пищи.
Распределение
Иптакопан характеризовался зависимым от концентрации связыванием с белками плазмы крови вследствие таргетного связывания с фактором B в системном кровотоке. В клинически значимых концентрациях в плазме крови связывание иптакопана с белками плазмы крови in vitro составило от 75 до 93 %. После применения иптакопана 200 мг два раза в сутки кажущийся объем распределения в равновесном состоянии был равен приблизительно 288 л.
Биотрансформация
Метаболизм является преобладающим путем выведения иптакопана, при этом приблизительно 50 % дозы метаболизируется по окислительному пути. Метаболизм иптакопана включает N- и O-деалкилирование, окисление и дегидрирование, главным образом происходящие с участием изофермента CYP2C8 (98 %) и в меньшей степени — изофермента CYP2D6 (2 %). Глюкуронизация (UGT1A1, UGT1A3, UGT1A8) является вторичным путем метаболизма. В плазме крови иптакопан являлся основным компонентом, формируя 83 % от AUC0-48 ч. Единственными метаболитами, в незначительном количестве обнаруженными в плазме крови, были два ацил-глюкуронида, формирующие 8 % и 5 % от AUC0-48 ч. Метаболиты иптакопана не считаются фармакологически активными.
Элиминация
В исследовании у человека после однократного приема внутрь [14С]-иптакопана в дозе 100 мг среднее значение общей экскреции радиоактивных веществ (иптакопана и метаболитов) составило 71,5 % с калом и 24,8 % с мочой, что дает общую среднюю экскрецию > 96 % от дозы. В частности, 17,9 % дозы выделялось с мочой в виде неизмененного иптакопана, 16,8 % — с калом. Период полувыведения (t1/2) иптакопана в равновесном состоянии составляет приблизительно 25 часов после применения препарата Фабхальта 200 мг два раза в сутки.
Линейность (нелинейность)
В диапазоне доз от 25 до 200 мг два раза в сутки фармакокинетические показатели иптакопана были в целом меньше дозопропорциональных. Тем не менее фармакокинетика иптакопана при приеме внутрь в дозах 100 мг и 200 мг была приблизительно пропорциональной.
Фармакокинетическая-фармакодинамическая зависимость
Влияние возраста, пола или расы
Анализ популяционной фармакокинетики проводили на основании данных 234 пациентов. Возраст, масса тела, рСКФ, раса и пол не оказывали значимого влияния на фармакокинетику иптакопана. Исследования с участием представителей монголоидной расы показали, что фармакокинетику иптакопана была сходна с таковой у представителей европеоидной расы.
Нарушение функции почек
Лишь 17,9 % иптакопана выводится с мочой в неизмененном виде. Таким образом, выведение почками является второстепенным путем элиминации. Влияние нарушения функции почек на клиренс иптакопана оценивали при помощи анализа популяционной фармакокинетики. Клинически значимых различий в клиренсе иптакопана между пациентами с нормальной функцией почек и пациентами с нарушением функции почек легкой (рСКФ (60 — < 90 мл/мин/1,73 м2) или средней (рСКФ 30 — < 60 мл/мин/1,73 м2) степени не выявлено, коррекции дозы не требовалось. Исследования применения препарата у пациентов с нарушением функции почек тяжелой степени или у пациентов, находящихся на гемодиализе, не проводили.
Нарушение функции печени
В исследовании с участием пациентов с нарушением функции печени легкой, средней и тяжелой степени наблюдалось незначительное изменение экспозиции иптакопана. Зарегистрировано приблизительно 1,04-кратное повышение Cmax иптакопана у пациентов с нарушением функции печени легкой степени (n = 8), у пациентов нарушением средней (n = 8) или тяжелой (n = 6) степени изменений не отмечено. У пациентов с нарушением функции печени легкой и тяжелой степени наблюдалось 1,03-кратное увеличение AUCinf, в то же время у пациентов с нарушением функции печени средней степени изменений не наблюдалось.
У пациентов с нарушением функции печени легкой, средней и тяжелой степени коррекция дозы не требуется.
Лекарственное взаимодействие
Исследования, направленные на изучение лекарственного взаимодействия иптакопана и других препаратов, проводились с участием здоровых добровольцев и не выявили какого- либо клинически значимого взаимодействия:
- При одновременном применении с клопидогрелом (умеренный ингибитор изофермента CYP2C8), Cmax и AUC иптакопана увеличивались на 5 % и 36 % соответственно.
- При одновременном применении с циклоспорином (сильный ингибитор транспортных полипептидов 1B1/1B3), Cmax и AUC иптакопана увеличивались на 41 % и 50 % соответственно.
- В присутствии иптакопана Cmax дигоксина (субстрат PgP) возрастала на 8%, в то время как его AUC не менялась.
В присутствии иптакопана Cmax и AUC розувастатина (субстрат OATP) не менялись.
Показания
Препарат Фабхальта показан в качестве монотерапии при лечении взрослых пациентов, страдающих пароксизмальной ночной гемоглобинурией (ПНГ) с гемолитической анемией.
Противопоказания
- наличие гиперчувствительности к иптакопану или к любому из вспомогательных веществ, перечисленных в разделе 1.
- отсутствие вакцинации против Neisseria meningitidis и Streptococcus pneumoniae, за исключением случаев, когда риск от задержки лечения препаратом Фабхальта перевешивает риск развития инфекции, вызванной этими инкапсулированными бактериями (см. раздел 4.).
- начало терапии у пациентов с неразрешившейся серьезной инфекцией, вызванной инкапсулированными бактериями, в т. ч. Streptococcus pneumoniae, Neisseria meningitidis или Haemophilus influenzae типа b.
Способ применения и дозы
Режим дозирования
Рекомендуемая доза составляет 200 мг (1 капсула) внутрь два раза в сутки.
Пропуск дозы
При пропуске приема одной или нескольких доз пациенту следует рекомендовать принять одну дозу препарата Фабхальта как можно скорее (даже незадолго до приема следующей запланированной дозы) и затем возобновить обычную схему лечения.
Пароксизмальная ночная гемоглобинурия (ПНГ) — это заболевание, которое требует длительного лечения. Прекращение лечения данным препаратом не рекомендовано без клинических показаний.
Переход с терапии ингибиторами C5 (экулизумаб, равулизумаб) или другой медикаментозной терапии ПНГ на препарат Фабхальта
Для снижения потенциального риска гемолиза при резком прекращении лечения:
- При переходе с терапии экулизумабом лечение препаратом Фабхальта следует начинать не позднее чем через 1 неделю после введения последней дозы экулизумаба.
- При переходе с терапии равулизумабом лечение препаратом Фабхальта следует начинать не позднее чем через 6 недель после введения последней дозы равулизумаба. При переходе с другой медикаментозной терапии ПНГ на лечение препаратом Фабхальта следует учесть интервал дозирования и механизм действия ранее применявшихся лекарственных препаратов.
Соблюдение режима дозирования
Медицинским работникам следует информировать пациентов с ПНГ о важности соблюдения режима дозирования, чтобы минимизировать риск гемолиза.
Особые группы пациентов
Пациенты с нарушением функции почек
Коррекция дозы у пациентов с нарушением функции почек легкой (расчетная скорость клубочковой фильтрации [рСКФ] 60 — < 90 мл/мин/1,73 м2) или средней (рСКФ 30 — < 60 мл/мин/1,73 м2) степени не требуется. Данные по применению препарата у пациентов с нарушением функции почек тяжелой степени, или находящихся на гемодиализе, отсутствуют. Выведение почками не является основным путем элиминации иптакопана и его метаболитов.
Пациенты с нарушением функции печени
Коррекция дозы у пациентов с нарушением функции печени легкой (класс А по классификации Чайлд — Пью), средней (класс В по классификации Чайлд — Пью) или тяжелой (класс С по классификации Чайлд — Пью) степени не требуется.
Пациенты пожилого возраста (65 лет и старше)
Коррекция дозы у пациентов в возрасте 65 лет и старше не требуется.
Дети
Безопасность и эффективность применения препарата Фабхальта у детей в возрасте младше 18 лет не установлены. Данные отсутствуют.
Предостережения, контроль терапии
Серьезные инфекции, вызванные инкапсулированными бактериями
Применение ингибиторов комплемента, таких как препарат Фабхальта, может предрасполагать к развитию серьезных, жизнеугрожающих или летальных инфекций, вызванных инкапсулированными бактериями. Для снижения риска инфекций все пациенты должны быть вакцинированы против инкапсулированных бактерий, включая Neisseria meningitidis и Streptococcus pneumoniae. Рекомендовано вакцинировать пациентов против Haemophilus influenzae типа b при наличии такой возможности.
Вакцинацию следует проводить по меньшей мере за 2 недели до первого приема препарата Фабхальта. Если лечение препаратом Фабхальта должно быть начато до проведения вакцинации, следует вакцинировать пациента как можно скорее. В таком случае после проведения вакцинации необходим профилактический курс антибактериальной терапии длительностью до 2 недель.
При необходимости пациенты могут быть ревакцинированы в соответствии с локальными рекомендациями по вакцинации.
Вакцинация снижает, но не полностью устраняет риск серьезных инфекций. Серьезная инфекция может быстро стать жизнеугрожающей или привести к летальному исходу, если ее не распознать и не начать лечение на ранней стадии. Пациентов необходимо проинформировать о ранних признаках и симптомах серьезных инфекций, и наблюдать на предмет развития серьезных инфекций. При подозрении на инфекцию пациента необходимо немедленно обследовать и провести необходимое лечение. Применение препарата Фабхальта во время лечения серьезной инфекции может рассматриваться после оценки рисков и пользы.
Мониторинг симптомов ПНГ после отмены препарата Фабхальта
После прекращения терапии препаратом Фабхальта, необходимо тщательно наблюдать пациента на предмет признаков и симптомов гемолиза в течение по крайней мере 2 недель после применения последней дозы. К таким признакам относятся: повышение активности лактатдегидрогеназы (ЛДГ) сопровождающейся также внезапным снижением концентрации гемоглобина или уменьшением размеров ПНГ-клона, утомляемостью, гемоглобинурией, болью в животе, одышкой, дисфагией, эректильной дисфункцией и большими нежелательными сосудистыми событиями (major adverse vascular events — MAVE), включая тромбоз. В случае необходимости прекращения лечения препаратом Фабхальта следует рассмотреть вопрос об альтернативных вариантах лечения.
В случае возникновения гемолиза после прекращения лечения препаратом Фабхальта следует рассмотреть вопрос о возобновлении лечения.
Максимальная длительность непрерывного применения препарата Фабхальта в проведенных клинических исследованиях составляет вплоть до 4 лет.
Фертильность, беременность и лактация
Беременность
Краткий обзор рисков
Данных по применению препарата Фабхальта у беременных женщин недостаточно для того, чтобы определить связанные с препаратом риски тяжелых дефектов развития, спонтанного прерывания беременности и иных неблагоприятных исходов для матери или плода. Отсутствие лечения ПНГ во время беременности сопряжено с рисками для матери и плода. Применение препарата Фабхальта у беременных женщин или женщин, планирующих беременность, может рассматриваться после оценки рисков и пользы.
Исследования по оценке влияния на репродуктивную функцию у крыс и кроликов демонстрируют, что пероральный прием препарата Фабхальта вплоть до наивысших доз во время органогенеза не оказывал токсических эффектов на эмбрион и плод. Это соответствует дозе, в 5 (у крыс) и 8 (у кроликов) раз превышающей максимальную рекомендуемую дозу для человека (МРДЧ) 200 мг два раза в сутки на основании значения AUC.
Клинические аспекты
Риск для матери и/или эмбриона/плода
Беременность у пациенток с пароксизмальной ночной гемоглобинурией ассоциируется с неблагоприятными исходами для матери, включая усугубление цитопении, тромботические явления, инфекции, кровотечение, выкидыши и повышенную материнскую смертность, а также с неблагоприятными исходами для плода, включая антенатальную гибель и преждевременные роды.
Данные, полученные на животных
В исследовании эмбриофетального развития на у крыс пероральное применение иптакопана в период органогенеза не оказывало нежелательного действия на материнский организм, эмбрион и плод вплоть до максимальной дозы в 1000 мг/кг/сут, что в 5 раз превышает МРДЧ по значениям AUC. Явления у крыс, не расцененные как нежелательные, включали: замедление окостенения костей черепа плода и формирование доброкачественных кист в левой теменной области, что не оказывало влияние на череп, головной мозг и другие структуры головы. Эти явления отмечались лишь у двух плодов в одном из 22 пометов при введении дозы 1000 мг/кг/сут.
В исследовании эмбриофетального развития у кроликов иптакопан не оказывал нежелательного токсического действия на эмбрион и плод при пероральном применении в любых дозах. В то же время, вследствие нежелательных снижения массы тела и уменьшения потребления корма, у беременных животных отмечалось токсическое действие на материнский организм при применении максимальных доз 450 мг/кг/сут, что в 8 раз превышает МРДЧ по значениям AUC.
В исследовании пре- и постнатального развития у крыс при пероральном применении иптакопана на протяжении беременности, родов и лактации (c дня 6 гестации до дня 21 лактации) не отмечалось нежелательного влияния на организм беременных самок или на потомство вплоть до максимальных доз 1000 мг/кг/сут (приблизительно в 5 раз превышает МРДЧ по значениям AUC).
Лактация
Краткий обзор рисков
В настоящее время не установлено, проникает ли иптакопан в грудное молоко после приема препарата Фабхальта внутрь. Данные по влиянию препарата Фабхальта на получающего грудное вскармливание ребенка или на выработку грудного молока отсутствуют.
Пользу грудного вскармливания для развития и здоровья ребенка следует соотнести с необходимостью приема матерью препарата Фабхальта и любыми потенциальными нежелательными явлениями (в том числе серьезными инфекциями, вызванными инкапсулированными бактериями) у грудного ребенка, обусловленными применением препарата Фабхальта или основным заболеванием матери.
Фертильность
Данные по влиянию препарата Фабхальта на фертильность у человека отсутствуют. В исследованиях фертильности на животных при пероральном применении иптакопан не оказывал влияния на фертильность самцов крыс вплоть до максимальных доз (750 мг/кг/сут), которые 6-кратно превышают МРДЧ по значениям AUC. В исследованиях токсичности при многократном применении наблюдалось обратимое воздействие в отношении мужской репродуктивной системы (дегенерация канальцев семенников и угнетение сперматогенеза) крыс и собак при пероральном приеме в дозах, >3-кратно превышающих МРДЧ по значениям AUC, без очевидного влияния на количество сперматозоидов, их морфологию и подвижность, или на фертильность.
В исследовании влияния на женскую фертильность и в исследовании раннего эмбрионального развития у крыс воздействие иптакопана ограничивалось увеличением числа выкидышей в пред- и постимплантационном периодах и как следствие уменьшением числа живых эмбрионов только при пероральном введении максимальной дозы 1000 мг/кг/сут, что ~5-кратно превышает МРДЧ по значениям AUC. Максимальная доза препарата, при применении которой не наблюдалось развитие нежелательных явлений, (no observed adverse effect level — NOAEL), — 300 мг/кг/сут, что ~2-кратно превышает МРДЧ по значениям AUC.
Влияние на способность управлять транспортными средствами и работать с механизмами
Препарат Фабхальта не оказывает или оказывает несущественное влияние на способность управлять транспортными средствами и работать с механизмами.
Данные доклинической безопасности
Данные доклинических исследований не выявили особой угрозы для человека, исходя из традиционных исследований фармакологической безопасности, токсичности многократных доз, генотоксичности, канцерогенного потенциала и репродуктивной токсичности.
Фармакологическая безопасность
Исследования безопасности иптакопана в отношении сердечно-сосудистой системы при пероральном приеме проводили у крыс, собак и обезьян. Влияния на сердечно-сосудистую систему у крыс после однократного перорального применения дозы 1000 мг/кг (эквивалентно ~10-кратному превышению МРДЧ по значениям Cmax) не наблюдалось. У собак в начале применения наблюдали дозозависимое повышение частоты сердечных сокращений и снижение артериального давления. Величина изменения частоты сердечных сокращений со временем уменьшалась, и этот эффект не рассматривали как нежелательный при применении препарата в дозах до 150 мг/кг/сут (эквивалентно ~14-кратному превышению МРДЧ по значениям AUC и ~19-кратному превышению МРДЧ по значениям Cmax). При применении в дозе 100 мг/кг (эквивалентно ~9-кратному превышению МРДЧ по значениям Cmax) не наблюдалось влияния на интервал QTc. У яванских макак отмечалось удлинение интервала QTc после однократного введения иптакопана в дозе ≥ 300 мг/кг (эквивалентно > 21-кратному превышению МРДЧ по значениям Cmax).
В доклинических исследованиях фармакологической безопасности не было обнаружено связанных с иптакопаном эффектов, влияющих на дыхательную или нервную систему.
Токсичность при многократном введении
Доклинический профиль безопасности иптакопана оценивали у крыс при пероральном применении в дозах до 750 мг/кг/сут (~7-кратное превышение МРДЧ по значениям AUC) в течение 26 недель и у собак при пероральном применении в дозах до 150 мг/кг/сут внутрь (~14-кратное превышение МРДЧ по значениям AUC) в течение 39 недель. Нежелательные и необратимые эффекты в исследованиях хронической токсичности ограничивались фиброзом костного мозга и нарушением эритропоэза у одной из собак при применении максимальной дозы. Обратимые и несерьезные нежелательные эффекты включали гипертрофию фолликулярных клеток щитовидной железы и дегенерацию канальцев семенников.
Нежелательное влияние на сердце (в т. ч. дегенерация клеток и фиброз) наблюдались только в краткосрочных исследованиях продолжительностью до 4 недель у собак при применении доз > 300 мг/кг/сут (что эквивалентно > 39-кратному превышению МРДЧ по значениям AUC).
Мутагенность и канцерогенность
Иптакопан не оказывал генотоксического и мутагенного действия в серии анализов in vitro и in vivo. Исследования канцерогенности иптакопана при пероральном применении у мышей и крыс не выявили канцерогенного потенциала. Максимальные дозы иптакопана, изученные у мышей (1000 мг/кг/сут) и крыс (750 мг/кг/сут), были приблизительно в 4 и 12 раз выше МРДЧ по значениям AUC соответственно.
Побочные эффекты
Резюме профиля безопасности
Профиль безопасности препарата Фабхальта составлен на основании анализа объединенных данных по безопасности нескольких клинических исследований, в ходе которых 164 пациентов с ПНГ получали препарат Фабхальта в дозе 200 мг два раза в сутки. Медиана продолжительности применения препарата Фабхальта составляла 10,2 месяца. Наиболее частыми нежелательными реакциями у пациентов, получавших лечение препаратом Фабхальта, были: инфекция верхних дыхательных путей (18,9 %), головная боль (18,3 %), диарея (11,0 %).
Табличное резюме нежелательных реакций
Нежелательные лекарственные реакции по данным клинических исследований (таблица 1) перечислены в соответствии с системно-органными классами MedDRA. В каждом системно-органном классе нежелательные лекарственные реакции представлены в порядке убывания частоты. В каждой категории частоты нежелательные лекарственные реакции представлены в порядке уменьшения степени серьезности. Кроме того, каждой нежелательной лекарственной реакции присвоена категория частоты, которая определяется на основании следующей классификации (CIOMS III): очень часто (≥ 1 / 10); часто (≥ 1 / 100 — < 1 / 10); нечасто (≥ 1 / 1000 — < 1 / 100); редко (≥ 1 / 10 000 — < 1 / 1000); очень редко (< 1 / 10 000).
Таблица 1. Нежелательные лекарственные реакции по данным клинических исследований у пациентов с ПНГ
|
Системно-органный класс MedDRA |
Нежелательные реакции |
Пул исследований ПНГ N = 164 n (%) |
Категория частоты |
|
Инфекции и инвазии |
Инфекция верхних дыхательных путей3 |
31 (18,9) |
Очень часто |
|
Бактериальная пневмония |
1 (0,6) |
Нечасто |
|
|
Инфекция мочевыводящих путей4 |
8 (4,9) |
Часто |
|
|
Бронхит5 |
4 (2,4) |
Часто |
|
|
Нарушения со стороны крови и лимфатической системы |
Сниженное количество тромбоцитов1 |
12 (7,3) |
Часто |
|
Нарушения со стороны нервной системы |
Головная боль6 |
30 (18,3) |
Очень часто |
|
Головокружение |
5 (3,0) |
Часто |
|
|
Нарушения со стороны желудочно-кишечного тракта |
Диарея |
18 (11,0) |
Очень часто |
|
Боль в животе2 |
16 (9,8) |
Часто |
|
|
Тошнота |
12 (7,3) |
Часто |
|
|
Нарушения со стороны кожи и подкожных тканей |
Крапивница |
1 (0,6) |
Нечасто |
|
Нарушения со стороны мышечной, скелетной и соединительной ткани |
Артралгия |
9 (5,5) |
Часто |
1. «Сниженное количество тромбоцитов» включает предпочтительные термины «тромбоцитопения» и «уменьшенное количество тромбоцитов».
|
|||
Описание отдельных нежелательных лекарственных реакций
Сниженное количество тромбоцитов
Снижение количества тромбоцитов в целом было легкой степени и имело транзиторный характер. У нескольких пациентов с уже имеющейся тромбоцитопенией наблюдалось дальнейшее снижение количества тромбоцитов до степени 3 или 4 (по критериям CTCAE версии 4.03).
Инфекции
В клинических исследованиях ПНГ, в том числе 2 и 3 фазы, у 1 из 164 пациентов с ПНГ зарегистрирована серьезная бактериальная пневмония во время лечения препаратом Фабхальта; пациент был вакцинирован против Neisseria meningitidis, Streptococcus pneumoniae и Haemophilus influenzae типа b. У пациента отмечено разрешение состояния после антибактериальной терапии на фоне продолжающегося лечения препаратом Фабхальта.
Лабораторные данные и жизненно важные показатели
Увеличение концентрации холестерина в крови и повышение артериального давления
У пациентов, получавших иптакопан в дозе 200 мг 2 раза в день в клинических исследованиях при ПНГ, на 6ом месяце отмечалось увеличение общего холестерина и холестерина липопротеинов низкой плотности в среднем приблизительно на 0,7 ммоль/л (28 мг/дЛ) от исходного показателя. Средние значения остались в пределах нормы. Отмечалось повышение артериального давления (АД), в особенности — диастолического АД (среднее увеличение на 6ом месяце составило 4,7 мм рт.ст.). Среднее диастолическое АД не превышало 80 мм рт. ст. У пациентов с ПНГ повышение концентрации общего холестерина, холестерина липопротеинов низкой плотности, а также увеличение диастолического АД коррелировало с увеличением концентрации гемоглобина (улучшение в отношении анемии). Клиническую значимость таких находок необходимо оценивать исходя из индивидуальных характеристик каждого пациента с последующим соответствующим ведением. Сообщения о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза — риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств — членов Евразийского экономического союза.
Российская Федерация
- Федеральная служба по надзору в сфере здравоохранения Адрес: 109012, Москва, Славянская площадь, д. 4, стр. 1
- Телефон: +7 (800) 550-99-03
- Электронная почта: pharm@roszdravnadzor.gov.ru
- Сайт в информационно-телекоммуникационной сети «Интернет»: www.roszdravnadzor.gov.ru
Передозировка
Данные по передозировке у человека ограничены. В клинических исследованиях несколько пациентов ежедневно принимали препарат Фабхальта в дозе до 800 мг с хорошей переносимостью. Максимальная однократная доза у здоровых добровольцев составляла 1200 мг при хорошей переносимости.
Во всех случаях подозрения на передозировку необходимо начать общие поддерживающие мероприятия и назначить симптоматическую терапию.
Взаимодействие
На основании приведенных ниже данных клинически значимое взаимодействие препарата Фабхальта с другими лекарственными препаратами не ожидается.
В клинически значимых концентрациях иптакопан не ингибирует основные изоферменты цитохрома P450 (CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 и 3A4/5) и не индуцирует изоферменты CYP1A2, 2B6, 2C8, 2C9 и 2C19. Иптакопан не ингибирует белки-переносчики MATE1, MATE2-K, OAT1, OAT3, OCT1 и OCT2. Иптакопан является субстратом изофермента CYP2C8 и белков-переносчиков OATP1B1/1B3.
Одновременный прием с клопидогрелом (умеренным ингибитором изофермента CYP2C8) или циклоспорином (сильным ингибитором белков-переносчиков OATP1B1/1B3) не приводил к клинически значимому увеличению Cmax или площади под фармакокинетической кривой концентрация-время (AUC)inf иптакопана.
Иптакопан не изменяет экспозицию дигоксина (субстрат P-гликопротеина (PgP)) и розувастатина (субстрат OATP).
Условия и сроки хранения
Срок годности (срок хранения)
- 2 года.
Особые меры предосторожности при хранении
- Хранить при температуре не выше 30 °С.

Приведенная научная информация, содержащая описание активных веществ лекарственных препаратов, является обобщающей. Содержащаяся на сайте информация не должна быть использована для принятия самостоятельного решения о возможности применения представленных лекарственных препаратов и не может служить заменой очной консультации врача.
