Артлегиа

Состав
Олокизумаб представляет собой гуманизированное (с присоединенным гипервариабельным участком) моноклональное антитело, относящееся к изотипу иммуноглобулина (immunoglobulin, Ig) G4/каппа.
Качественный и количественный состав
Действующее вещество: олокизумаб.
Каждый мл раствора содержит 160 мг олокизумаба.
Каждый флакон с 0,4 мл раствора содержит 64 мг олокизумаба.
Каждый преднаполненный шприц с 0,4 мл раствора содержит 64 мг олокизумаба.
Вспомогательные вещества, наличие которых надо учитывать в составе лекарственного препарата: натрий, сорбитол Е420.
Перечень вспомогательных веществ
- Натрия хлорид
- Полисорбат 80
- L-гистидина гидрохлорида моногидрат
- Сорбитол
- Вода для инъекций.
Лекарственная форма
Раствор для подкожного введения.
Прозрачная или слегка опалесцирующая жидкость от бесцветного до светло-желтого цвета.
Теоретическое значение осмоляльности – 400 мОсм/кг.
Характер и содержание первичной упаковки
По 0,4 мл препарата во флаконах вместимостью 2 мл из прозрачного боросиликатного стекла (тип I), укупоренных пробками из хлорбутилкаучука или из бромбутилкаучука и герметизированных колпачком комбинированным алюминиевым с пластмассовой отщелкивающейся крышкой.
По 1 флакону вместе с инструкцией по применению (листок-вкладыш) в картонную пачку.
По 0,4 мл препарата в шприцах вместимостью 1 мл из прозрачного стекла (тип I), снабженных пластиковым упором для пальцев и стальной иглой, защищенной пластиковым колпачком и закрытых эластомерной плунжерной пробкой, в которую ввинчивается полипропиленовый шток плунжера.
По 1 преднаполненному шприцу в картонный вкладыш, предназначенный для минимизации перемещения штока плунжера.
По 1 вкладышу с преднаполненным шприцем в комплекте с 1 индивидуально упакованной спиртовой салфеткой вместе с инструкцией по применению (листок-вкладыш) в картонную пачку.
Фармакодинамика
Механизм действия
Олокизумаб – это препарат гуманизированных (с присоединенным гипервариабельным участком [complementarity determining region, CDR]) моноклональных антител, относящихся к изотипу иммуноглобулина (immunoglobulin, Ig) G4/каппа. Олокизумаб селективно связывается с человеческим ИЛ-6 и эффективно нейтрализует действие ИЛ-6 in vivo и in vitro. Полученные данные свидетельствуют о том, что олокизумаб не связывается в значительной степени с другими молекулами семейства ИЛ-6 и не влияет на их функционирование, а также не активирует сигнальный путь ИЛ-6.
ИЛ-6 представляет собой многофункциональный цитокин, который играет центральную роль в регуляции иммунных процессов, воспаления, гемопоэза и онкогенеза, нарушения сигнального пути ИЛ-6 лежат в основе патогенеза многих заболеваний. Было показано, что избыточная продукция ИЛ-6 вносит существенный вклад в развитие и прогрессирование ревматоидного артрита. Системное ингибирование сигнального пути ИЛ-6 приводит к снижению интенсивности воспаления, уменьшению выраженности суставных симптомов, таких как боль, припухлость и скованность, уменьшению проявлений слабости и улучшению физической функции у пациентов с активным ревматоидным артритом, недостаточно контролируемым метотрексатом или ингибиторами фактора некроза опухоли (ФНО).
Фармакодинамические эффекты
В клиническом исследовании 2а фазы RA0010 однократное подкожное введение олокизумаба в дозе 1 мг/кг и 3 мг/кг пациентам с ревматоидным артритом (РА) приводило к снижению среднего значения (± стандартное отклонение) содержания С-реактивного белка (СРБ) в плазме крови в течение первых 24 часов после введения препарата, продолжавшегося в течение 7 дней от начала лечения (исходное содержание СРБ составляло 9,4 (±11,1) мг/л и 3,4 (±2,7) мг/л, через 24 часа после введения 5,7 (±6,8) мг/л и 2,9 (±3,1) мг/л, через 7 дней после введения 0,6 (±0,6) мг/л и 0,5 (±0,4) мг/л, соответственно). После однократного введения содержание СРБ сохранялось на низком уровне в течение 10 недель. В исследованиях 2 фазы RA0056 и RA0083 у пациентов с ревматоидным артритом средней или высокой степени активности при многократном введении олокизумаба в дозе от 60 до 480 мг/мес в течение 12 недель также было продемонстрировано устойчивое снижение содержания СРБ в плазме крови. Среднее геометрическое содержания СРБ в плазме по группам лечения составляло от 5,0 до 11,3 мг/л до введения препарата, и не превышало 1 мг/л для всех исследованных доз через 1 неделю после начала лечения и далее в течение всего периода терапии.
В двойных слепых контролируемых исследованиях третьей фазы CREDO1, CREDO2 у пациентов с ревматоидным артритом средней или высокой степени активности, недостаточно контролируемым метотрексатом, и в исследовании CREDO3, у пациентов с ревматоидным артритом средней или высокой степени активности с недостаточным клиническим ответом на терапию ингибиторами фактора некроза опухоли (иФНО), также было показано, что подкожное введение олокизумаба в дозе 64 мг каждые 2 недели (к2н) или 64 мг каждые 4 недели (к4н) вызывало снижение среднего содержания СРБ в плазме до нормальных значений через 2 недели после начала терапии. Низкое содержание СРБ в плазме крови сохранялось в течение 24 недель на протяжении всего периода лечения.
Клиническая эффективность и безопасность
Эффективность подкожного введения олокизумаба была изучена в трех рандомизированных двойных слепых контролируемых многоцентровых исследованиях 3 фазы.
В исследованиях CREDO1 и CREDO2 принимали участие 428 и 1648 пациентов с ревматоидным артритом средней или высокой степени активности, недостаточно контролируемым метотрексатом. Пациенты получали олокизумаб в дозе 64 мг каждые 2 недели (к2н) и каждые 4 недели (к4н), или плацебо в течение 24 недель одновременно с фоновой терапией метотрексатом в дозе от 15 до 25 мг/нед (или ≥10 мг/нед при наличии документально подтвержденной непереносимости более высоких доз). В случае отсутствия ответа на терапию после 14 недель лечения пациентам могли быть дополнительно назначены сульфасалазин и/или гидроксихлорохин.
В исследовании CREDO3 принимали участие 368 пациентов с ревматоидным артритом средней или высокой степени активности с недостаточным ответом на предшествующую терапию иФНО. Пациенты получали олокизумаб в дозе 64 мг к2н и к4н в течение 24 недель или плацебо в течение 16 недель. Через 16 недель от начала лечения пациенты из группы плацебо были повторно рандомизированы для получения олокизумаба в дозе 64 мг к2н и к4н до завершения 24-недельного периода лечения. Все пациенты одновременно получали фоновую терапию метотрексатом в дозе от 15 до 25 мг/нед (или ≥10 мг/нед при наличии документально подтвержденной непереносимости более высоких доз). В случае отсутствия ответа на терапию после 14 недель лечения пациентам могли быть дополнительно назначены сульфасалазин и/или гидроксихлорохин.
Применение олокизумаба в обеих дозировках совместно с метотрексатом было значительно эффективнее совместного применения метотрексата и плацебо, и приводило к уменьшению выраженности симптомов ревматоидного артрита, а также позволяло достичь низкой активности заболевания или ремиссии у большего количества пациентов. При анализе эффективности олокизумаба в исследованиях CREDO1, CREDO2 и CREDO3 частота ответа, измеренная по ACR20 (Критерий эффективности ответа на терапию ревматоидного артрита Американской коллегии ревматологов), оценивалась в зависимости от региона, пола, возраста, веса и индекса массы тела на момент включения в исследование, тяжести заболевания, времени с момента установления диагноза, длительности предшествующего применения метотрексата, серологического статуса. Никакие из вышеперечисленных переменных не оказали значимого влияния на ответ на терапию олокизумабом. Воздействие олокизумаба было заметным уже через 4 недели лечения, выраженный эффект развивался приблизительно через 12 недель от начала введения препарата и сохранялся в течение не менее чем 24 недель двойного слепого исследования, а также на протяжении 82 недель открытого исследования CREDO4, в которое входили пациенты, завершившие исследования CREDO1, CREDO2 и CREDO3.
В открытом продолженном исследовании CREDO4 терапия метотрексатом была отменена у 111 пациентов, преимущественно из-за развития нежелательных явлений. После прекращения применения метотрексата у данных пациентов, перешедших на монотерапию олокизумабом, не отмечено нарастания активности ревматоидного артрита.
Фармакокинетика
Абсорбция
Биодоступность олокизумаба оценивалась на основании данных, полученных для 173 пациентов с легким или умеренным ревматоидным артритом, получавших олокизумаб в различных дозах в течение 12 недель, объединенных с данными, полученными у 40 пациентов с легким или умеренным ревматоидным артритом после однократного введения различных доз олокизумаба и данными, полученными у 41 здорового добровольца после однократного введения различных доз олокизумаба. При подкожном введении биодоступность составляет 63 %.
После однократного подкожного введения олокизумаба пациентам с легким или умеренным ревматоидным артритом в дозах от 0,3 до 6 мг/кг максимальная концентрация препарата в плазме крови (Cmax) дозозависимо возрастала. Время достижения Cmax составляло от 4 до 12 дней, при этом поддающиеся определению уровни олокизумаба сохранялись приблизительно до 16 недель.
После однократного подкожного введения олокизумаба в дозе 64 мг пациентам с ревматоидным артритом средней и тяжелой степени, недостаточно контролируемым на фоне лечения метотрексатом, Cmax достигалась в среднем через 7-10 дней (Таблица 4).
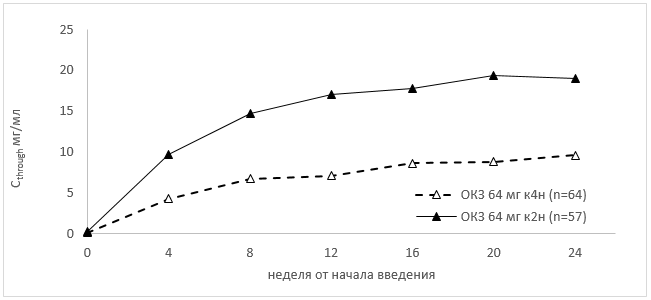
При многократном введении концентрация олокизумаба в плазме крови нарастала в течение начального периода терапии и достигала равновесного состояния через 16 (64 мг к4н) и 14 (64 мг к2н) недель от начала лечения (Таблица 4, Рисунок 1).
Таблица 4. Фармакокинетические параметры олокизумаба после подкожного введения пациентам с РА средней и тяжелой степени
|
ФК параметр |
Исходные значения |
Неделя 20 |
||
|
ОКЗ 64 мг к4н N = 18 |
ОКЗ 64 мг к2н N = 18 |
ОКЗ 64 мг к4н N = 18 |
ОКЗ 64 мг к2н N = 18 |
|
|
Cmax (мкг/мл) |
6,18 |
6,22 |
17,00 |
21,55 |
|
%CV |
50,0 |
39,2 |
55,7 |
25,0 |
|
AUC0-tau* (мкг*ч/мл) |
2886 |
1556 |
8411 |
5485 |
|
%CV |
45,3 |
38,9 |
29,9 |
31,8 |
|
tmax (ч) |
190,2 |
234,4 |
244,5 |
127,8 |
|
Медиана |
166,5 |
236,7 |
167,6 |
96,7 |
|
Мин. - макс. |
92,8 – 402,3 |
95,8 – 359,2 |
95,4 – 670,7 |
0,0 – 334,7 |
Рисунок 1. Динамика нарастания минимальной концентрации (Cthrough) при многократном подкожном введении пациентам с ревматоидным артритом средней и тяжелой степени
Биотрансформация
Не применимо к моноклональным антителам. Ожидаемым метаболизмом является деградация до небольших неактивных пептидов и аминокислот. Однако было показано, что олокизумаб обращал ингибиторный эффект ИЛ-6 на активность некоторых ферментов CYP, вовлеченных в метаболизм других препаратов (см. раздел 4.5.).
Элиминация
Фармакокинетическая-фармакодинамическая зависимость
Уровень снижения СРБ у пациентов с активным ревматоидным артритом, получавших олокизумаб, не зависел от дозы препарата. Кроме того, у пациентов с легким и умеренным ревматоидным артритом была выявлена положительная корреляция концентрации олокизумаба в плазме с уровнем нейтропении, повышением уровней АСТ, АЛТ и триглицеридов в плазме, хотя величина эффекта была невелика. Также к 14 дню после введения олокизумаба наблюдалось стойкое снижение уровня VEGF и амилоидного сывороточного белка А во всех терапевтических группах без зависимости от дозы.
Данные доклинической безопасности
В доклинических данных, полученных по результатам стандартных исследований фармакологической безопасности, токсичности при многократном введении, генотоксичности, канцерогенного потенциала и репродуктивной и онтогенетической токсичности, особый вред для человека не выявлен.
Имеются следующие нежелательные реакции, не обнаруженные в клинических исследованиях, но выявленные у животных при воздействии олокизумаба в дозах, схожих с дозами, примененными в клинических исследованиях, что может иметь клиническую значимость.
Во время родов имели место случаи гибели получавших лечение олокизумабом беременных самок (связанные с дозой, все дозы) без продромальных признаков, а также некоторых новорожденных у получавших лечение олокизумабом матерей. Данные указывают на увеличение частоты тяжелых родов, связанных с задержкой плаценты и, в некоторых случаях, со значительными урогенитальными кровотечениями, в основе которых, прямо или опосредованно, может лежать механизм действия препарата. Предполагается, что ИЛ-6 играет важную роль в раскрытии шейки матки и, возможно, в рождении плаценты. Смертность у новорожденных яванских макак считалась скорее обусловленной травмами, причиной которых были патологические роды и/или неспособность матери позаботиться о новорожденном или накормить его сразу после рождения, чем непосредственно связанной с лечением. Принимая во внимание сходство физиологии человека и яванского макака в период беременности и учитывая риск патологических родов и кровотечений при родах, ингибирование сигнального пути ИЛ-6 в период беременности не рекомендуется.
Показания
Препарат Артлегиа показан к применению у взрослых в возрасте от 18 лет.
Ревматоидный артрит
Терапия пациентов 18 лет и старше с ревматоидным артритом средней или высокой степени активности в комбинации с метотрексатом, при недостаточной эффективности терапии метотрексатом или ингибиторами фактора некроза опухоли (иФНО).
Новая коронавирусная инфекция (COVID-19)
Патогенетическая терапия синдрома высвобождения цитокинов при новой коронавирусной инфекции (COVID-19) среднетяжелого и тяжелого течения.
Противопоказания
- Гиперчувствительность к действующему веществу или к любому из вспомогательных веществ, перечисленных в разделе 6.1.
- Активные инфекционные заболевания (в том числе и туберкулез).
- Детский возраст до 18 лет.
- Наследственная непереносимость фруктозы (препарат содержит сорбитол).
- Период грудного вскармливания.
Способ применения и дозы
У пациентов с ревматоидным артритом, а также новой коронавирусной инфекцией (COVID-19) терапия препаратом Артлегиа может быть инициирована и проводиться только под контролем врача, имеющего опыт диагностики и лечения соответствующих заболеваний.
Режим дозирования
Ревматоидный артрит
Рекомендуемая доза составляет 64 мг 1 раз каждые 4 недели. При высокой степени активности ревматоидного артрита со значением индекса активности DAS28 ≥ 6,9 может быть рассмотрено увеличение кратности инъекций препарата — 64 мг 1 раз каждые 2 недели подкожно.
Новая коронавирусная инфекция (COVID-19)
Рекомендуемая доза составляет 64 мг однократно.
Пропуск дозы
Ревматоидный артрит
Если была пропущена очередная инъекция препарата, следует ввести пропущенную дозу как можно быстрее, при этом интервал между любыми двумя введениями должен составлять не менее половины интервала выбранного режима дозирования (Таблица 1).
Таблица 1. Действия в случае пропуска инъекции
|
Режим дозирования |
Интервал от даты пропуска |
Действие |
|
ОКЗ 64 мг к4н |
≤ 14 дней |
Выполнить инъекцию вместо пропущенной и далее по графику |
|
>14 дней |
Отменить пропущенную инъекцию |
|
|
ОКЗ 64 мг к2н |
≤ 7 дней |
Выполнить инъекцию вместо пропущенной и далее по графику |
|
>7 дней |
Отменить пропущенную инъекцию |
ОКЗ — олокизумаб; к2н — каждые 2 недели; к4н — каждые 4 недели
Прекращение применения препарата
Ревматоидный артрит
Терапию препаратом Артлегиа следует отменить, если у пациента наблюдается:
Повышение биохимических показателей функции печени, соответствующее следующим условиям:
- повышение уровня АСТ или АЛТ >8 верхних границ нормы (ВГН) в любое время независимо от уровня общего билирубина или сопутствующей симптоматики.
- повышение уровня АСТ или АЛТ >5 ВГН в течение ≥2 недель после инъекции независимо от уровня общего билирубина или сопутствующей симптоматики.
- повышение уровня АСТ или АЛТ >3 ВГН и уровня общего билирубина >2 ВГН.
- повышение уровня АСТ или АЛТ >3 ВГН, сопровождающееся симптомами поражения печени (усталость, тошнота, рвота, боль или болезненность в верхнем правом квадранте живота, лихорадка или сыпь).
У пациента наблюдаются любые из перечисленных ниже лабораторных отклонений:
- абсолютное количество нейтрофилов <500×106/л (<500 /мм3).
- количество лимфоцитов по результатам двух последовательных анализов <500×106/л (<500 /мм3).
- количество тромбоцитов <50×109/л (<50000 /мм3 или <50000×106/л).
Подтвержденная беременность во время применения препарата Артлегиа.
Перфорация желудочно-кишечного тракта.
Тяжёлая или угрожающая жизни инфекция.
Особые группы пациентов
Пациенты пожилого возраста (> 65 лет)
Коррекция дозы не требуется.
Пациенты с нарушением функции почек
Безопасность и эффективность препарата Артлегиа у пациентов с почечной недостаточностью не изучалась. Данные по применению отсутствуют.
Пациенты с нарушением функции печени
Безопасность и эффективность препарата Артлегиа у пациентов с печеночной недостаточностью не изучалась. Данные по применению отсутствуют.
Дети
Безопасность и эффективность препарата Артлегиа у детей и подростков младше 18 лет на данный момент не установлены. Данные по применению отсутствуют.
Способ применения
Препарат Артлегиа вводится подкожно, в область бедра или передней брюшной стенки, 0,4 мл раствора с концентрацией 160 мг/мл единовременно. Перед введением раствор следует нагреть до комнатной температуры. Время хранения препарата при температуре > 8 °С не должно превышать 4 часов.
Первое применение препарата проводят под контролем квалифицированного медицинского сотрудника. После первой инъекции следует наблюдать за состоянием пациента в течение 30 минут. После обучения технике выполнения подкожных инъекций под контролем медицинского сотрудника пациент (или лицо, осуществляющее за ним уход) может вводить препарат самостоятельно. Решение о возможности самостоятельного введения препарата Артлегиа пациентом принимает врач, имеющий опыт диагностики и лечения ревматоидного артрита.
Для введения препарата Артлегиа следует использовать только шприцы для однократного применения.
Предостережения, контроль терапии
С осторожностью
- У пациентов с серьезными или оппортунистическими инфекциями в анамнезе; с сопутствующими заболеваниями и состояниями, являющимися факторами риска развития инфекций (сахарный диабет, почечная недостаточность, прием иммуносупрессивных препаратов, пожилой возраст и др.).
- У пациентов, контактировавших с больными туберкулезом. Перед применением препарата Артлегиа у таких пациентов следует оценить соотношение риска и пользы применения препарата.
- У пациентов с дивертикулитом или перфорациями кишечника в анамнезе и другими факторами риска перфорации кишечника.
- У пациентов с нарушениями функции печени и печеночной недостаточностью.
Особые указания
Анафилактические или анафилактоидные реакции
Введение препаратов, содержащих белки, может быть связано с возникновением иммунологических/аллергических или неиммунологических реакций повышенной чувствительности к препарату, которые могут быть тяжелыми. Эти реакции могут возникать в виде острой инфузионной реакции, аллергической реакции или реакции гиперчувствительности замедленного типа. Таким образом, первое введение препарата Артлегиа следует выполнять в медицинском учреждении, где имеются лекарственные средства и оборудование для купирования анафилактических и анафилактоидных реакций. В клинических исследованиях был отмечен случай серьезной анафилактической реакции на введение препарата Артлегиа.
Почечная недостаточность
Пациентов с почечной недостаточностью не включали в клиническое исследование препарата Артлегиа. В связи с отсутствием данных следует соблюдать осторожность при применении препарата Артлегиа у пациентов с нарушениями функции почек.
Вакцинация
Безопасность иммунизации живыми вакцинами на фоне применения ингибиторов ИЛ-6, в том числе олокизумаба, не установлена. Пациентов с необходимостью вакцинации живыми вакцинами не включали в клиническое исследование.
Злокачественные новообразования
Данные о безопасности применения олокизумаба у пациентов со злокачественными новообразованиями отсутствуют, риск развития злокачественных опухолей на фоне терапии препаратом Артлегиа не известен.
Применение при ревматоидном артрите
Инфекции
Для пациентов, получающих иммуносупрессивные препараты, включая блокаторы сигнального пути ИЛ-6, характерна повышенная частота развития инфекций. Применение препарата Артлегиа связано с повышенным риском развития или активизацией инфекций. Не следует начинать терапию препаратом Артлегиа пациентам с инфекциями в активной фазе. Следует с осторожностью проводить лечение препаратом Артлегиа пациентов, имеющих факторы риска развития инфекций. При развитии серьезных инфекций терапию препаратом Артлегиа следует прекратить. Пациентов следует проинструктировать о возможных признаках и симптомах развития инфекции, требующих немедленного обращения к врачу.
Туберкулезная инфекция
Перед началом терапии препаратом Артлегиа необходимо провести обследование пациента на наличие латентной формы туберкулезной инфекции. Пациентам с выявленной латентной формой туберкулезной инфекции перед началом терапии препаратом Артлегиа следует провести стандартный курс противотуберкулезной терапии.
Следует с осторожностью назначать препарат Артлегиа пациентам, находящимся в тесном контакте (совместное проживание или нахождение в других замкнутых пространствах, например, на рабочем месте, на общественных собраниях или в здании на протяжении длительных периодов в течение дня) с лицом, страдающим активным туберкулезом. Перед применением препарата Артлегиа у таких пациентов следует тщательно оценить соотношение риска и пользы применения препарата.
Риск перфорации желудочно-кишечного тракта
При применении ингибиторов сигнального пути ИЛ-6 известны случаи перфорации желудочно-кишечного тракта (ЖКТ), в основном на фоне дивертикулита или других воспалительных заболеваний ЖКТ. У пациентов с ревматоидным артритом наблюдались случаи перфорации ЖКТ при применении олокизумаба, в том числе с летальным исходом. Следует соблюдать осторожность при применении препарата Артлегиа у пациентов с дивертикулитом или перфорацией кишечника в анамнезе и другими факторами риска перфорации кишечника. При появлении желудочно-кишечных симптомов, таких как абдоминальная боль, на фоне лечения препаратом Артлегиа, следует незамедлительно провести обследование пациента.
Нарушения функции печени
Применение препарата Артлегиа так же, как и других ингибиторов ИЛ-6, связано с повышением уровня АЛТ, АСТ и гамма-глутамилтрансферазы (см. раздел 4.8). Пациентов с уровнем АЛТ или АСТ ≥1,5×ВГН в популяции ревматоидного артрита не включали в клинические исследования. Следует соблюдать осторожность при применении препарата Артлегиа у пациентов с нарушениями функции печени и печеночной недостаточностью.
Мониторинг лабораторных показателей крови
В клинических исследованиях было зарегистрировано снижение абсолютного числа нейтрофилов и лейкоцитов на фоне лечения препаратом Артлегиа и другими ингибиторами ИЛ-6. По данным применения других ингибиторов ИЛ-6, нейтропения на фоне лечения не приводила к повышению частоты инфекций. Пациентов с уровнем лейкоцитов <3,5 × 109/л, уровнем нейтрофилов <2000 × 106/л (<2000/мм3) в популяции ревматоидного артрита не включали в клинические исследования.
Применение препарата Артлегиа без метотрексата
Возможна отмена терапии метотрексатом при возникновении непереносимости метотрексата. По данным исследования CREDO4, отмена метотрексата в таких случаях не приводила к снижению эффективности лечения.
Применение при коронавирусной инфекции (COVID-19)
Инфекции
Препарат Артлегиа не следует назначать пациентам с COVID-19, у которых имеется другая сопутствующая тяжелая активная инфекция. Следует соблюдать осторожность при применении препарата Артлегиа у пациентов с хроническими и рецидивирующими инфекциями в анамнезе, а также при наличии сопутствующих заболеваний, которые предрасполагают к развитию инфекций (например, сахарный диабет, дивертикулит).
Риск перфорации желудочно-кишечного тракта
При применении ингибиторов сигнального пути ИЛ-6 известны случаи перфорации желудочно-кишечного тракта, в основном на фоне дивертикулита или других воспалительных заболеваний ЖКТ. У пациентов с COVID-19 единичные случаи перфорации ЖКТ при применении олокизумаба, в том числе с летальным исходом наблюдались на пострегистрационном этапе применения. Следует соблюдать осторожность при применении препарата Артлегиа у пациентов с дивертикулитом или перфорацией кишечника в анамнезе и другими факторами риска перфорации кишечника. При появлении желудочно-кишечных симптомов, таких как абдоминальная боль, на фоне лечения препаратом Артлегиа, следует незамедлительно провести обследование пациента.
Нарушения функции печени
У пациентов с COVID-19 может наблюдаться повышенная активность АЛТ и АСТ, так как полиорганная недостаточность с поражением печени является осложнением COVID-19 тяжелого течения. Применение препарата Артлегиа так же, как и других ингибиторов ИЛ-6, связано с повышением уровня АЛТ, АСТ и гамма-глутамилтрансферазы (см. раздел 4.8). Пациентов с уровнем АЛТ или АСТ ≥3 × ВГН в популяции COVID-19 не включали в клинические исследования. Следует соблюдать осторожность при применении препарата Артлегиа у пациентов с нарушениями функции печени и печеночной недостаточностью. У пациентов с COVID-19 следует осуществлять мониторинг активности АЛТ/АСТ в соответствии с клиническими рекомендациями.
Мониторинг лабораторных показателей крови
В клинических исследованиях было зарегистрировано снижение абсолютного числа нейтрофилов и лейкоцитов на фоне лечения препаратом Артлегиа и другими ингибиторами ИЛ-6. По данным применения других ингибиторов ИЛ-6, нейтропения на фоне лечения не приводила к повышению частоты инфекций. Пациентов с уровнем лейкоцитов <2 × 109/л, уровнем нейтрофилов <500 × 106/л (<500/мм3) в популяции COVID-19 не включали в клинические исследования.
Вспомогательные вещества
Данный препарат содержит менее 1 ммоль (23 мг) натрия на один флакон или преднаполненный шприц, то есть по сути не содержит натрия.
Пациентам с редко встречающейся наследственной непереносимостью фруктозы не следует применять этот препарат.
Фертильность, беременность и лактация
Женщины с детородным потенциалом
Перед назначением препарата Артлегиа женщинам детородного возраста следует выполнить тест на беременность. Лечащий врач должен подробно разъяснить риски применения препарата Артлегиа во время беременности и проинструктировать пациентку, способную к деторождению, о необходимости использования высокоэффективных методов контрацепции и выполнения регулярных тестов на беременность во время лечения и в течение по крайней мере 6 месяцев после получения последней дозы препарата Артлегиа. В случае, если пациентка, получающая препарат Артлегиа, забеременеет, она должна немедленно прекратить применение препарата и обратиться к врачу.
Беременность
Безопасность и эффективность применения препарата Артлегиа при беременности изучены недостаточно. В исследованиях на животных репродуктивная токсичность не была исключена. Предполагается, что ИЛ-6 играет важную роль в раскрытии шейки матки и, возможно, в рождении плаценты. Таким образом, применение препарата Артлегиа может нарушать родовую деятельность. Так, у животных наблюдалось увеличение частоты тяжелых родов, связанных с задержкой плаценты и, в некоторых случаях, со значительными кровотечениями из родовых путей. Значение данной информации для людей не известно.
В рамках клинических исследований было зафиксировано 6 случаев беременности, из них 5 пациенток получали сопутствующую терапию метотрексатом. Из 6 случаев беременности 2 беременности были прерваны по решению пациентки или врача (аборт), 2 беременности закончились рождением живого ребенка в срок (одни самопроизвольные вагинальные роды, одно родоразрешение путем кесарева сечения), 1 беременность оказалась внематочной, в связи с чем также была прервана, исходом еще 1 беременности являлся самопроизвольный аборт (выкидыш).
Не следует применять олокизумаб во время беременности за исключением тех случаев, когда имеется очевидная клиническая необходимость.
Лактация
Проникновение олокизумаба в грудное молоко не изучалось. Клинические данные о риске для ребенка, находящегося на грудном вскармливании, отсутствуют. Так как препарат Артлегиа показан к применению в комбинации с метотрексатом, который секретируется в грудное молоко, рекомендуется прекратить грудное вскармливание при назначении препарата.
Фертильность
Клинические данные о влиянии олокизумаба на фертильность у человека отсутствуют.
В исследованиях на животных отрицательного воздействия олокизумаба на фертильность самцов и самок яванских макак не обнаружено.
Влияние на способность управлять транспортными средствами и работать с механизмами
Исследования по изучению влияния препарата на способность управлять транспортными средствами и механизмами не проводились. Хотя на данный момент при терапии олокизумабом нежелательные реакции, связанные с головокружением, не отмечались, головокружение часто наблюдалось при терапии другими ингибиторами ИЛ-6. Пациентам, испытывающим головокружение во время терапии препаратом Артлегиа, следует рекомендовать не управлять транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Особые меры предосторожности при уничтожении использованного лекарственного препарата или отходов, полученных после применения лекарственного препарата и другие манипуляции с препаратом
Инструкция по подготовке к инъекции и введению препарата
Извлеките флакон или преднаполненный шприц с препаратом Артлегиа из холодильника заранее: следует подождать примерно 30 минут перед инъекцией, чтобы препарат нагрелся до комнатной температуры.
Не подогревайте препарат.
Подготовьтесь к инъекции
Шаг 1
Вымойте руки теплой водой с мылом, выберите ровную чистую поверхность, внимательно осмотрите флакон или преднаполненный шприц с препаратом и не используйте его, если:
- он был извлечен из холодильника более 4 часов назад,
- на нем указано неправильное название препарата,
- истек срок годности, указанный на упаковке,
- на флаконе или преднаполненном шприце имеются трещины, повреждения или утечка препарата,
- раствор мутный, изменил цвет или содержит хлопья, или частицы.
Препарат в преднаполненном шприце готов к применению.
Препарат во флаконе подготовьте к применению следуя инструкции.
Приготовьте одноразовый шприц для подкожных инъекций вместимостью 1-2 мл, две одноразовых стерильных инъекционных иглы (рекомендуется использовать иглу размера 18G для набора препарата из флакона и иглу 27G для выполнения подкожной инъекции), 2 салфетки стерильные спиртовые.
Шаг 2
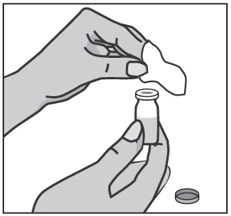
Наденьте на шприц более толстую иглу для набора препарата, не снимая защитный колпачок. Удалите пластмассовую защитную крышку с флакона, протрите резиновую пробку стерильной спиртовой салфеткой.
Возьмите шприц в правую руку, удалите колпачок с иглы шприца и введите иглу вертикально в центр пробки флакона так, чтобы кончик иглы появился с внутренней стороны пробки.
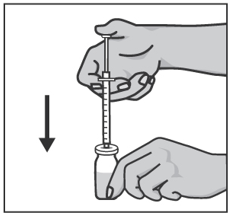
Удерживая правой рукой шприц, возьмите левой рукой флакон и переверните его так, чтобы вся жидкость собралась над пробкой. Оттягивая поршень шприца вниз, наберите в шприц все содержимое флакона.
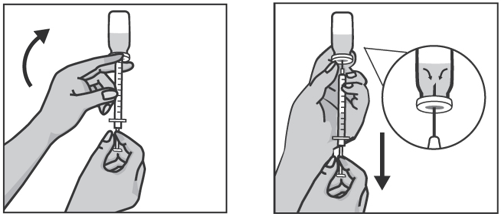
Вытащите иглу из флакона и закройте колпачком. Не снимая защитный колпачок замените на иглу для подкожных инъекций. Использованную иглу для набора препарата выбросьте в контейнер для острых предметов.
Внимание! Не выполняйте инъекцию иглой для набора препарата, это может привести к боли и повреждениям в месте инъекции.
Шаг 3
Осторожно снимите колпачок с иглы для подкожных инъекций. Не прикасайтесь к ней и соблюдайте осторожность чтобы не уколоться кончиком иглы. Удерживайте шприц вертикально и постучите по нему пальцем, чтобы пузырьки воздуха поднялись вверх. Удерживая шприц вертикально, медленно сдвиньте поршень чтобы изгнать из шприца воздух и избыточный объем жидкости так, чтобы поршень шприца остановился на отметке 0,4 мл.
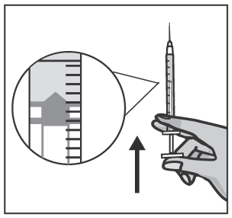
Поместите шприц на картонную коробку таким образом, чтобы игла оставалась сверху упаковки и не касалась других поверхностей.
Выберите место для инъекции
Выберите место инъекции на верхней части бедра или на животе на расстоянии не менее 5 см от пупка. Если инъекции делает медицинский работник, то препарат можно вводить в другие места для подкожных инъекций. Не рекомендуется введение препарата в места родинок, шрамов, повреждений или уплотнений, покраснений, повышенной чувствительности кожных покровов.
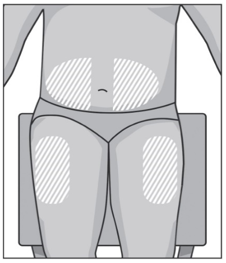
Рекомендуется регулярно менять место введения препарата. Новое место для инъекции должно находиться на расстоянии не менее 2,5 см от предыдущего места инъекции. При желании можно поочередно выполнять инъекции под кожу бедер и живота.
Выполните инъекцию
Протрите кожу выбранного места инъекции новой стерильной спиртовой салфеткой. Позвольте месту инъекции высохнуть и не прикасайтесь к нему до инъекции.
Осторожно сожмите кожу вокруг обработанного места инъекции второстепенной рукой (например, если Вы правша, используйте левую руку) и плотно удерживайте ее.
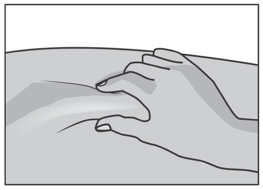
Удерживайте шприц в ведущей руке над приподнятым участком кожи под углом 90 градусов. Воткните иглу в кожу быстрым плавным толкающим движением. Если количество подкожного жира на брюшной стенке невелико, можно выполнять инъекцию под углом 45 градусов.
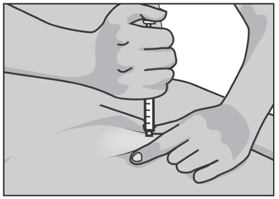
Не смещайте иглу относительно тканей и медленно нажимайте на поршень, пока весь объем препарата из шприца не будет введен под кожу. Поршень должен достичь дна шприца. Подождите несколько секунд перед извлечением иглы.
Извлеките иглу из кожи под тем же углом, под которым она была введена. В месте инъекции возможно небольшое кровотечение. При необходимости приложите стерильную салфетку на место инъекции.
Помните!
Выбрасывайте использованные шприцы в контейнер для острых предметов сразу после инъекции. Когда контейнер будет заполнен полностью, аккуратно и тщательно закройте его и выкиньте в мусорное ведро.
Всегда используйте новый шприц, не используйте повторно старые шприцы.
Весь оставшийся лекарственный препарат и отходы следует уничтожить в установленном порядке.
Побочные эффекты
Нежелательные реакции
Ниже представлена информация о нежелательных реакциях у взрослых пациентов с ревматоидным артритом, получавших олокизумаб.
Резюме профиля безопасности
Безопасность применения препарата Артлегиа при ревматоидном артрите средней или высокой степени активности оценивалась в рандомизированных контролируемых клинических исследованиях III фазы CREDO1, CREDO2 и CREDO3, а также в открытом исследовании CREDO4, в ходе которых олокизумаб получили 2355 пациентов. Все пациенты находились на фоновой терапии метотрексатом. В исследовании CREDO4 получены долгосрочные данные по безопасности для пациентов, завершивших рандомизированные контролируемые исследования фазы III и получавших олокизумаб до 106 недель (24-недельная двойная слепая терапия в основных исследованиях CREDO1, CREDO2 или CREDO3 и 82 недели терапии в исследовании CREDO4).
Наиболее часто встречающимися нежелательными реакциями в популяции пациентов с ревматоидным артритом были инфекции, повышение активности печеночных трансаминаз, повышение содержания холестерина, липидов и триглицеридов в крови, лейкопения, нейтропения и повышение артериального давления.
Табличное резюме нежелательных реакций
Нежелательные реакции классифицированы по системно-органным классам и по частоте встречаемости с использованием следующих категорий: очень часто (≥1/10); часто (≥1/100, но <1/10); нечасто (≥1/1000, но <1/100); редко (≥1/10 000, но <1/1000); очень редко (<1/10 000), частота неизвестна (на основании имеющихся данных оценить невозможно).
Таблица 2. Нежелательные лекарственные реакции, отмечавшиеся при терапии олокизумабом в популяции пациентов с ревматоидным артритом по данным клинических исследований (n=2355) и пострегистрационного опыта применения
|
Системно-органный класс |
Класс частоты |
||
|
Очень часто |
Часто |
Нечасто |
|
|
Инфекции и паразитарные заболевания |
латентный туберкулез; фарингит; назофарингит; инфекция верхних дыхательных путей, бронхит, инфекция мочевыводящих путей, конъюнктивит, Herpes Zoster |
сепсис; флегмона1; пневмония; абсцесс подкожно-жировой клетчатки; абсцесс конечности; ушная инфекция2; фолликулит; грибковая инфекция кожи; инфекция, вызываемая бактериями рода Helicobacter; ячмень; паронихия; онихомикоз; периодонтит; инфекция дыхательных путей; инфекция зуба; вульвовагинальный микоз |
|
|
Нарушения со стороны крови и лимфатической системы |
лейкопения; нейтропения; тромбоцитопения; лимфопения |
лимфоцитоз; лимфаденопатия; эозинофилия; повышение количества эритроцитов в крови |
|
|
Нарушения со стороны иммунной системы |
лекарственная гиперчувствительность |
||
|
Нарушения со стороны эндокринной системы |
гипотиреоз |
||
|
Нарушения метаболизма и питания |
дислипидемия; гиперхолестеринемия; гипертриглицеридемия; гиперлипидемия |
сахарный диабет; гиперкалиемия; гипернатриемия; ожирение; дефицит витамина Д |
|
|
Нарушения со стороны психики |
бессонница |
||
|
Нарушения со стороны нервной системы |
шейно-плечевой синдром; мигрень; парестезия; ишиас; вертебробазиллярная недостаточность |
||
|
Нарушения со стороны органа зрения |
катаракта; аллергический конъюнктивит; отек века; кератит |
||
|
Нарушения со стороны органа слуха и лабиринта |
тиннитус |
||
|
Нарушения со стороны сердца |
стенокардия; фибрилляция предсердия; предсердная тахикардия; синусовая тахикардия; брадикардия; желудочковые экстрасистолы; экстрасистолы; недостаточность митрального клапана; недостаточность трехстворчатого клапана |
||
|
Нарушения со стороны сосудов |
гипертензия |
атеросклероз аорты; тромбоз глубоких вен; диабетическая ангиопатия; гематома; тромбофлебит; варикоз вен |
|
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
легочный фиброз; астма; ателектаз; дисфония; одышка; носовое кровотечение; интерстициальное заболевание легких; боль в ротоглотке; ринорея; заложенность дыхательных путей; вазомоторный ринит |
||
|
Нарушения со стороны желудочно-кишечного тракта |
диарея; боль в животе |
стоматит; вздутие живота; запор; кариес зуба; полип желудка; гастрит; гастроэзофагиальная рефлюксная болезнь; геморрой; одинофагия; зубная боль; перфорация желудочно-кишечного тракта |
|
|
Нарушения со стороны печени и желчевыводящих путей |
повышенная активность аланинаминотранс-феразы |
повышенная активность аспартатаминотрансфе-разы; повышенная активность печеночных ферментов; повышенная активность трансаминаз3; повышенные показатели ФПП; повышенная концентрация прямого и непрямого билирубина |
холелитиаз; нарушение со стороны печени |
|
Нарушения со стороны кожи и подкожных тканей |
сыпь; дерматит |
актинический кератоз; образование волдыря; сухость кожи; экхимоз; эритема; гипергидроз; гиперкератоз; реакции фоточувствительности; зуд; поражения кожного покрова; крапивница |
|
|
Нарушения со стороны мышечной, скелетной и соединительной ткани |
скелетно-мышечная боль4 |
миозит; мышечный спазм; поражение межпозвоночных дисков; суставный выпот; остеохондроз; остеопения; остеопороз; подошвенный фасциит; синдром вращательной манжеты плеча; остеоартрит позвоночника |
|
|
Нарушения со стороны почек и мочевыводящих путей |
хроническая болезнь почек; гематурия; нефролитиаз; нефропатия; протеинурия; почечная колика |
||
|
Нарушения со стороны репродуктивной системы и молочных желез |
маточное кровотечение |
||
|
Врожденные, семейные и генетические нарушения |
гиперлипидемия; тип V |
||
|
Общие нарушения и реакции в месте введения |
реакции в месте инъекции |
астения; лекарственная непереносимость; слабость; боль |
|
|
Лабораторные и инструментальные данные |
повышение уровня ГГТ |
повышенный уровень гемоглобина; увеличение показателя гематокрита; повышение уровня адипонектина; увеличение веса; позитивный тест на микобактерию туберкулеза |
|
ГГТ — гаммаглутамилтрансфераза; ФПП — функциональные пробы печени
* Количество пациентов в популяции безопасности: CREDO1 – 285, CREDO2 – 940, CREDO3 – 357, CREDO 4 – 773 дополнительных пациента (1331 пациент продолжали участие в CREDO4 после основных исследований) – всего 2355.
1 — термин «флегмона» включает также рожистое воспаление
2 — термин «ушная инфекция» включает также средний и наружный отит
3 — термин «повышенная активность трансаминаз» включает также гипертрасаминаземию
4 — термин «скелетно-мышечная боль» включает также скелетно-мышечную боль в груди, боль в спине, боль в шее, боль в позвоночнике и миалгию
Описание отдельных нежелательных реакций
Перфорации желудочно-кишечного тракта
Перфорации желудочно-кишечного тракта (ЖКТ) могут развиваться при применении ингибиторов сигнального пути ИЛ-6, в основном на фоне дивертикулита или других воспалительных заболеваний ЖКТ. В ходе клинических исследований олокизумаба в популяции пациентов с ревматоидным артритом регистрировались отдельные случаи перфорации ЖКТ, в том числе с летальным исходом.
Реакции гиперчувствительности
В популяции пациентов с ревматоидным артритом средней или высокой степени активности, участвовавших в плацебо-контролируемых исследованиях CREDO1, CREDO2 и CREDO3, у 9,2 % пациентов, получавших олокизумаб, отмечались системные реакции на введение препарата и реакции гиперчувствительности, в основном легкой и средней тяжести. Наиболее часто в сводной группе олокизумаба, включающей 1582 пациента, отмечались сыпь (1,77 %), дерматит (1,01 %) и повышение уровня эозинофилов в крови (0,57 %). В исследовании CREDO3 в популяции с недостаточной эффективностью ингибиторов ФНО, был зарегистрирован один случай анафилактической реакции у пациента, получавшего олокизумаб в дозе 64 мг к4н.
Инфекции
В популяции пациентов с ревматоидным артритом средней или высокой степени активности, участвовавших в плацебо-контролируемых исследованиях CREDO1, CREDO2 и CREDO3, из 1582 пациентов, получавших олокизумаб, хотя бы один случай инфекции был зарегистрирован у 28,2 % пациентов, частота инфекций была несколько выше, чем в группе плацебо (27,5 %).
В популяции пациентов с ревматоидным артритом средней или высокой степени активности, участвовавших в плацебо-контролируемых исследованиях CREDO1, CREDO2 и CREDO3, и получавших олокизумаб, были зарегистрированы следующие серьезные инфекции: сепсис, в том числе вызванный стафилококковой инфекцией (0,32 %), флегмона (0,25 %) и рожистое воспаление (0,13 %), пневмония (0,19 %), абсцесс подкожно-жировой клетчатки (0,13 %), легочный туберкулез (0,13 %). В ходе клинической разработки олокизумаба регистрировались отдельные случаи серьезных инфекций (сепсис, легочный туберкулез) с летальным исходом.
Нейтропения
В популяции пациентов с ревматоидным артритом средней или высокой степени активности, участвовавших в плацебо-контролируемых исследованиях CREDO1, CREDO2 и CREDO3, среднее абсолютное число нейтрофилов через 12 недель терапии снизилось в группах, получавших олокизумаб (1582 пациента), по сравнению с плацебо (454 пациента), и затем оставалось стабильным до конца периода лечения.
Повышение активности печеночных трансаминаз и уровня билирубина
В популяции пациентов с ревматоидным артритом средней или высокой степени активности, участвовавших в плацебо-контролируемых исследованиях CREDO1, CREDO2 и CREDO3, повышение активности АЛТ, расцененное исследователями как нежелательное явление, наблюдалось у 11,4 % пациентов, получавших олокизумаб, и у 3,9 % пациентов в группе плацебо. Повышение активности АСТ, расцененное исследователями как нежелательное явление, наблюдалось у 6,9 % пациентов в группе, получавшей олокизумаб, и у 3,3 % пациентов в группе плацебо.
У большей части пациентов повышенная активность трансаминаз не сопровождалась клиническими проявлениями и не приводила к отмене лечения.
Повышение уровня билирубина, расцененное исследователями как нежелательное явление, наблюдалось у 1,52 % пациентов в группе, получавшей олокизумаб, и у 0,22 % пациентов в группе плацебо.
У большинства пациентов повышение активности трансаминаз не сопровождалось повышением концентрации билирубина. Одновременный подъем АЛТ и АСТ > 3×ВГН и билирубина > 2×ВГН был отмечен у одного пациента, получавшего олокизумаб 64 мг к2н.
В ходе клинических исследований у пациентов с ревматоидным артритом регистрировались случаи нарушений со стороны печени, расцененные исследователями как гепатотоксичность и лекарственно-индуцированное поражение печени, однако в большинстве случаев эти нарушения сопровождались только повышением трансаминаз, в одном случае дополнительно была зафиксирована гипербилирубинемия.
Гиперлипидемия
В популяции пациентов с ревматоидным артритом средней или высокой степени активности, участвовавших в плацебо-контролируемых исследованиях CREDO1, CREDO2 и CREDO3, повышение содержания липидов в крови на фоне лечения, расцененное исследователями как нежелательное явление, наблюдалось у 6,32 % пациентов, получавших олокизумаб, и у 2,42 % пациентов, получавших плацебо.
В среднем уровни общего холестерина, ЛПНП и ЛПВП возрастали в группах пациентов, получавших олокизумаб, в течение первых 4 недель терапии, и затем оставались стабильными до конца периода лечения.
Реакции в месте инъекции
В популяции пациентов с ревматоидным артритом средней или высокой степени активности, участвовавших в плацебо-контролируемых исследованиях CREDO1, CREDO2 и CREDO3, реакции в месте инъекции были зарегистрированы у 3,67 % пациентов, получавших олокизумаб. Наиболее часто отмечались эритема, зуд и кровотечение в месте инъекции.
Ниже представлена информация о нежелательных реакциях у взрослых пациентов с коронавирусной инфекцией (COVID-19), получавших олокизумаб.
Резюме профиля безопасности
Безопасность применения препарата Артлегиа у пациентов с коронавирусной инфекцией (COVID-19) среднетяжелого и тяжелого течения оценивалась в клиническом исследовании III фазы, в ходе которого олокизумаб получили 124 пациента. Наиболее часто встречающимися нежелательными реакциями в популяции пациентов с коронавирусной инфекцией (COVID-19) были повышение активности аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) и инфекции.
Табличное резюме нежелательных реакций
Нежелательные реакции классифицированы по системно-органным классам и по частоте встречаемости с использованием следующих категорий: очень часто (≥1/10); часто (≥1/100, но <1/10); нечасто (≥1/1000, но <1/100); редко (≥1/10 000, но <1/1000); очень редко (<1/10 000), частота неизвестна (на основании имеющихся данных оценить невозможно).
Таблица 3. Нежелательные лекарственные реакции, отмечавшиеся при терапии олокизумабом в популяции пациентов с короновирусной инфекцией (COVID-19) по данным клинического исследования (n=124) и пострегистрационного опыта применения
|
Системно-органный класс |
Класс частоты |
||
|
Часто |
Нечасто |
Частота неизвестна |
|
|
Инфекции и инвазии |
инфекции мочевыводящих путей |
сепсис |
|
|
Нарушения со стороны крови и лимфатической системы |
лейкоцитоз; лейкопения, нейтропения |
лимфопения; нейтрофилия |
|
|
Лабораторные и инструментальные данные |
повышение уровня аланинаминотрансфе-разы; повышение уровня аспартатаминотрансфе-разы; повышение уровня ГГТ; повышение уровня трансаминаз |
повышение уровня кальция в крови; наличие кристаллов в моче; уменьшение количества лейкоцитов |
|
|
Нарушения метаболизма и питания |
гипоальбуминемия; гипопротеинемия |
||
|
Желудочно-кишечные нарушения |
перфорация желудочно-кишечного тракта* |
||
|
Нарушения со стороны почек и мочевыводящих путей |
глюкозурия |
||
|
Нарушения со стороны кожи и подкожных тканей |
крапивница |
||
|
Нарушения со стороны сосудов |
разрыв вены |
||
* Выявлено по данным пострегистрационного опыта применения
Описание отдельных нежелательных реакций
Сепсис
В ходе клинических исследований регистрировались случаи сепсиса у пациентов с COVID-19, получавших олокизумаб, в том числе с летальным исходом. Достоверных различий в частоте развития сепсиса с группой плацебо в настоящее время не установлено, однако инфекционные осложнения являются характерными для класса ингибиторов ИЛ-6.
Перфорация желудочно-кишечного тракта
На пострегистрационном этапе у пациентов с COVID-19, получавших олокизумаб, регистрировались единичные случаи перфорации желудочно-кишечного тракта (ЖКТ), в том числе с летальным исходом.
Сообщения о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного препарата с целью обеспечения непрерывного мониторинга соотношения «польза – риск» лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств — членов Евразийского экономического союза.
Передозировка
В клинических исследованиях случаев передозировки не наблюдалось. Однако дополнительные клинические данные показывают, что общий профиль безопасности олокизумаба у пациентов, получавших препарат в дозе 240 мг к2н (480 мг в месяц) в течение 12 недель сопоставим с общим профилем безопасности у пациентов, получавших препарат в рекомендованной дозе.
Взаимодействие
Одновременное применение с метотрексатом не влияло на экспозицию олокизумаба. Не ожидается также влияния олокизумаба на экспозицию метотрексата при их одновременном применении, клинические данные отсутствуют. Во всех клинических исследованиях у пациентов с ревматоидным артритом олокизумаб применялся совместно с метотрексатом. По результатам клинического исследования CREDO1 не сообщалось о случаях клинически значимых лекарственных взаимодействий олокизумаба с другими препаратами.
Экспрессия печеночных изоферментов системы CYP450 подавляется под действием цитокинов, таких как ИЛ-6, которые стимулируют хроническое воспаление. Таким образом, при проведении терапии средствами, ингибирующими действие цитокинов (например, олокизумаб), экспрессия изоферментов CYP450 может изменяться.
В исследовании in vitro на криоконсервированных гепатоцитах человека олокизумаб обращал ингибиторный эффект ИЛ-6 на активность CYP1A1/2, 2B6, 2C9, 3A4/5 и 2C19, а также на активность NTCP.
В исследовании у пациентов с активным ревматоидным артритом концентрации мидазолама (субстрата CYP3A4) и омепразола (субстрата CYP2C19) через 1 неделю после однократного введения олокизумаба снижались на 32 % и 26 % соответственно.
Влияние олокизумба на ферменты CYP может быть клинически значимым для субстратов CYP450 с узким терапевтическим индексом, где доза подбирается индивидуально. Таким образом, следует принимать во внимание, что у пациентов с активным ревматоидным артритом может потребоваться коррекция доз препаратов, метаболизируемых данными изоформами CYP, после начала применения препарата Артлегиа.
После начала или прекращения применения препарата Артлегиа следует наблюдать за пациентами, получающими лекарственные средства в индивидуально подобранных дозах, которые метаболизируются посредством изоферментов CYP450 (список не является исчерпывающим): статины (симвастатин, ловастатин, аторвастатин); оральные контрацептивы; блокаторы кальциевых каналов; глюкокортикоиды (дексаметазон, метилпреднизолон); варфарин; хинидин; теофиллин; тизанидин; фенитоин; пимозид; циклоспорин; сиролимус; такролимус; бензодиазепины (например, диазепам, алпразолам, триазолам, мидазолам, бромазепам).
Действие олокизумаба на активность изоферментов CYP450 может сохраняться в течение нескольких недель после прекращения терапии.
Несовместимость
В связи с отсутствием исследований совместимости данный лекарственный препарат не следует смешивать с другими лекарственными препаратами.
Условия и сроки хранения
Срок годности (срок хранения)
- 3 года.
Особые меры предосторожности при хранении
- Хранить в защищённом от света месте при температуре от 2 до 8 °С.
- Не замораживать.
- Время хранения препарата при температуре > 8 °С не должно превышать 4 часов.

Приведенная научная информация, содержащая описание активных веществ лекарственных препаратов, является обобщающей. Содержащаяся на сайте информация не должна быть использована для принятия самостоятельного решения о возможности применения представленных лекарственных препаратов и не может служить заменой очной консультации врача.
