Октофактор
Состав
1 флакон с препаратом содержит:
Активное вещество:
мороктоког альфа 250 МЕ, 500 МЕ, 1000 МЕ или 2000 МЕ;
Вспомогательные вещества:
натрия хлорид 36,0 мг,
сахароза 12,0 мг,
гистидин 6,0 мг,
кальция хлорида дигидрат
(в пересчете на безводное вещество) 1,0 мг,
полоксамер 407 0,4 мг.
1 флакон с растворителем содержит:
натрия хлорида раствор 0,9 % для инъекций - 5 мл.
Описание:
Лиофилизат: Аморфная масса от белого до белого со слегка желтоватым оттенком
цвета.
Растворитель: Прозрачная бесцветная жидкость.
Восстановленный раствор: прозрачный или слабо опалесцирующий бесцветный или слегка желтоватого цвета раствор.
Фармакодинамика
Активное вещество препарата - рекомбинантный фактор свертывания крови VIII с удаленным B-доменом (мороктоког альфа), представляет собой гликопротеин с молекулярной массой около 165 000 дальтон.
Рекомбинантный фактор свертывания крови VIII продуцируется модифицированной перевиваемой линией клеток СНО 2Н5, полученной трансфекцией клеток яичников китайского хомячка, и выделяется с использованием технологий рекомбинантной ДНК.
Рекомбинантный фактор свёртывания крови VIII, так же как и эндогенный, участвует во внутреннем механизме свёртывания крови, образуя в присутствии тромбоцитарных фосфолипидов и ионизированного кальция комплекс с фактором свёртывания крови IX. Данный комплекс активирует фактор свёртывания крови X. Последний обеспечивает преобразование протромбина в тромбин, который, в свою очередь, превращает фибриноген в фибрин, что приводит к образованию кровяного сгустка.
Мороктоког альфа имеет сходные фармакологические свойства с одной из форм эндогенного фактора свёртывания крови VIII, поэтому может использоваться для заместительной терапии при дефиците фактора свёртывания VIII у пациентов с гемофилией А с целью уменьшения выраженности геморрагического синдрома.
Фармакокинетика
По фармакокинетическим параметрам рекомбинантный фактор VIII с удалённым В-доменом (мороктоког альфа) эквивалентен полноцепочечному рекомбинантному фактору VIII (октокогу альфа) и плазматическому фактору VIII.
Уровень активности фактора VIII в плазме после введения Октофактора ранее леченным пациентам с гемофилией А составляет 76-112 %. Активность Октофактора в плазме снижается по двухфазной экспоненте. В начальной фазе происходит распределение препарата из сосудистого русла в другие жидкости организма с периодом полувыведения из плазмы от 3 до 6 ч; примерно от 2/3 до 3/4 фактора VIII остаётся в системном кровотоке. В последующей медленной фазе (которая, вероятно, отражает потребление фактора VIII) период полувыведения составляет в среднем 12,69 ч, а среднее время удержания Октофактора в организме 17 - 38 ч. Среднее значение клиренса соответствует 2,94 дл/ч.
Показания
Лечение и профилактика кровотечений у пациентов с гемофилией А (врождённой недостаточностью фактора свёртывания крови VIII) в возрасте 12 лет и старше.
Примечание: препарат Октофактор не содержит фактор Виллебранда, поэтому не показан для лечения болезни Виллебранда.
Противопоказания
Повышенная чувствительность к белкам хомячков, а также непереносимость любого из компонентов, входящих в состав препарата. Детский возраст до 12 лет (опыт применения отсутствует).
Способ применения и дозы
Октофактор вводится внутривенно струйно медленно в течение 5-10 минут после разведе-ния лиофилизата прилагаемым растворителем.
Доза фактора свёртывания крови VIII измеряется в международных единицах (МЕ). 1 МЕ активности фактора свертывания VIII эквивалентна количеству фактора свертывания VIII в 1 мл плазмы крови здорового человека.
Активность фактора свёртывания VIII в плазме крови выражается в процентах (относительно нормальных значений плазмы крови человека) или в МЕ на единицу объёма (МЕ/дл).
Расчёт дозы фактора свёртывания крови VIII основывается на эмпирически полученных данных о том, что 1 МЕ фактора VIII/кг массы тела повышает активность данного фактора в плазме крови в среднем на 2 МЕ/дл, что составляет приблизительно 2 % от нормальной активности.
Разовая доза Октофактора рассчитывается по следующей формуле:
|
Необходимое количество МЕ фактора VIII |
= |
Масса тела (в кг) × |
Необходимое повышение активности фактора VIII (% или МЕ/дл) |
× |
0,5 (МЕ/кг на МЕ/дл), |
где величине 0,5 (МЕ/кг на МЕ/дл) соответствует удвоенный инкремент степени восстановления активности, обычно наблюдаемый после введения фактора VIII.
Вследствие различия степени восстановления активности in vivo и периода полувыведения препарата, возможны индивидуальные особенности реакции пациентов на лечение рекомбинантным фактором свертывания крови VIII.
Во время заместительной терапии препаратом Октофактор, а также обширных оперативных вмешательствах необходимо контролировать активность фактора свёртывания VIII в плазме крови лабораторными методами.
При развитии приведенных в таблице геморрагических проявлений активность фактора VIII в плазме крови не должна опускаться ниже указанных уровней (в % от нормы или в МЕ/дл) в течение соответствующего периода времени.
Таблица расчета доз Октофактора при различных видах кровотечений и оперативных вмешательствах
|
Вид кровотечения или оперативного вмешательства |
Необходимая активность фактора свёртывания крови VIII (% или МЕ/дл) |
Периодичность введения (часы)/ продолжительность терапии (дни) |
|
Кровотечения |
||
|
Ранняя фаза гемартроза, кровоизлияние в мышцу или кровотечение в полость рта |
20-40 |
Повторные инъекции препарата каждые 12-24 ч, как минимум в течение 1 суток до остановки кровотечения. |
|
Более выраженный ге-мартроз, кровоизлия-ние в мышцу или гема-тома |
30-60 |
Повторные инъекции каждые 12-24 ч в те-чение 3–4 дней или более, до разрешения болевого синдрома и острого нарушения функции. |
|
Угрожающее жизни кровотечение |
60-100 |
Повторные инъекции каждые 8 ч до пол-ной остановки кровотечения, далее – под-держивающая терапия в течение 14 дней с интервалом 24 ч. |
|
Оперативные вмешательства |
||
|
Малое, включая удале-ние зуба |
30-60 |
Повторные инъекции каждые 24 ч, как минимум в течение 1 суток до остановки кровотечения. |
|
Обширное |
80-100 (до и после операции) |
Повторные инъекции каждые 8-24 ч, до заживления раны, затем терапия на протя-жении не менее 7 дней для поддержания активности фактора свёртывания крови VIII на уровне 30-60 % (МЕ/дл). |
Для долгосрочной профилактики кровотечений у пациентов, страдающих тяжёлой формой гемофилии А, средняя доза препарата составляет 20-40 МЕ/кг с интервалом введения каждые 2-3 дня. В некоторых ситуациях, например, у пациентов молодого возраста, может потребоваться сокращение интервалов между введениями или повышение дозы препарата.
Применение Октофактора более 1 раза в сутки, как правило, не требуется.
Применение у пациентов с заболеваниями печени и почек
Необходимость изменения дозы у пациентов с заболеваниями печени и почек в клинических исследованиях препарата Октофактор не изучалась.
Применение в педиатрии
У детей в возрасте от 12 до 18 лет Октофактор применялся для профилактики кровотечений в дозах 30-40 МЕ/кг, которые аналогичны дозам взрослых пациентов.
На фоне профилактического лечения отмечался в среднем 1 эпизод кровотечения за 6 месяцев наблюдения. Опыт применения препарата Октофактор у пациентов младше 12 лет отсутствует.
Применение при беременности и в период лактации
Исследования на животных влияния фактора свертывания VIII на репродуктивную систему не проводились. Учитывая редкость возникновения гемофилии А у женщин, данные о применении препаратов фактора свертывания крови VIII при беременности и в период лактации отсутствуют. В связи с этим, следует применять препарат Октофактор только при наличии строгих показаний.
Правила приготовления раствора для внутривенного введения
Общие положения
- Тщательно вымойте руки перед проведением нижеописанных процедур и выполняйте правила асептики в процессе приготовления и введения раствора препарата.
- Открытые медицинские материалы используйте, по возможности, быстро, чтобы сократить до минимума время их контакта с атмосферным воздухом.
- Достаньте флакон с препаратом и растворителем из холодильника и слегка нагрейте, например, подержав их в руках. Не допускается нагревание препарата выше 37 оС.
- Поставьте оба флакона на чистую ровную поверхность.
- Снимите защитную пластиковую накладку с каждого флакона.
- Обработайте резиновые пробки флаконов салфеткой спиртовой. Дайте им высохнуть перед использованием. Не прикасайтесь руками или другими предметами к обработанным поверхностям.
Использование канюль аспирационных
- Откройте блистерную упаковку канюли аспирационной. Снимите защитный колпачок с иглы канюли (рис. 1).
- Введите пластиковую иглу канюли вертикально в центр резиновой пробки флакона с растворителем до упора (рис. 2).
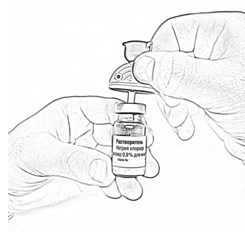
- Откройте блистерную упаковку шприца, отогнув до середины бумажное покрытие, и вставьте шприц в отверстие канюли, открыв синюю защитную крышечку (рис. 3). Убедитесь в плотности соединения.
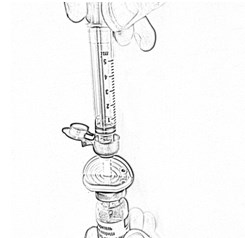
- Переверните флакон вверх дном и отберите в шприц 4 мл растворителя, плавно оттягивая поршень (рис. 4).
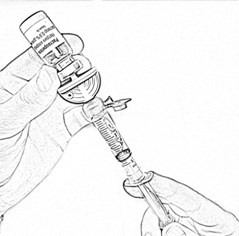
- Откройте блистерную упаковку второй канюли аспирационной, снимите защитный колпачок с иглы и введите пластиковую иглу в резиновую пробку флакона с препаратом, до упора (рис. 5).
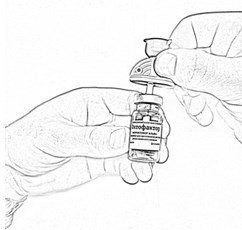
- Удалите наполненный шприц из первой канюли (см. поз. 10), оставляя переходник в пробке флакона с остатком растворителя. Следите за тем, чтобы кончик шприца не соприкасался с рукой или другими предметами.
- Вставьте шприц с растворителем во вторую канюлю, установленную на флаконе с препаратом, открыв синюю защитную крышечку (рис.6). Убедитесь в плотности соединения.
- Осторожно нажимая на стержень поршня и слегка наклоняя флакон, медленно введите 4 мл растворителя по стенке флакона через канюлю (рис. 6). Эффект «вспенивания» появляется, если растворитель попадает непосредственно на лиофилизат.
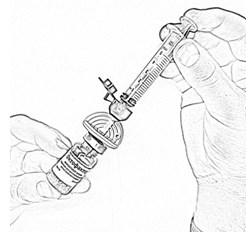
- Осторожно покачивайте флакон круговыми движениями, пока всё вещество не растворится (рис. 7). Не встряхивайте флакон. Убедитесь в том, что порошок полностью растворился. При наличии любых включений или мутности не используйте раствор.
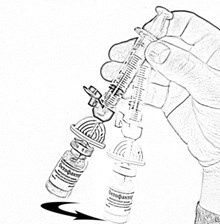
- Держа флакон в слегка наклоненном положении, отберите из него весь раствор в шприц через канюлю, медленно и плавно оттягивая поршень. Убедитесь в том, что весь приготовленный раствор перешёл в шприц. Удалите воздух из шприца, перевернув флакон вверх дном (рис. 8). Отложите флакон со шприцем и канюлей до следующей манипуляции.
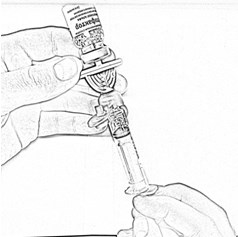
- Откройте блистерную упаковку катетера для периферических вен.
- Не меняя положения поршня (см. п. 16), удалите наполненный шприц из канюли, оставив переходник в пробке пустого флакона.
Дальнейшие манипуляции описаны в конце раздела «Использование адаптера для флаконов», подраздел «Общие положения», начиная с пункта 17.
Использование адаптера для флаконов.
- Откройте блистерную упаковку адаптера для флаконов (рис.9).
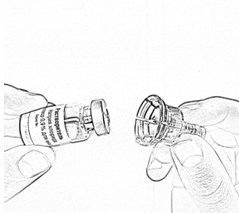
- Наденьте адаптер на флакон с растворителем до слабого щелчка - прокола пробки (рис.10).
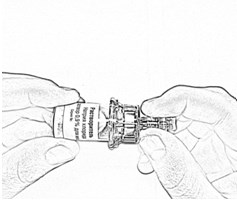
- Откройте блистерную упаковку шприца с резьбовым разъемом, отогнув до середины бумажное покрытие, и вверните резьбовой разъем шприца в резьбовой разъем адаптера (рис. 11). Убедитесь в плотности соединения.
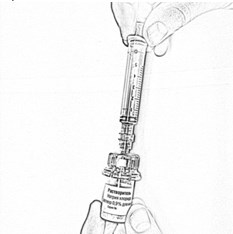
- Переверните флакон вверх дном и отберите в шприц 4 мл растворителя, плавно оттягивая поршень (рис. 12).
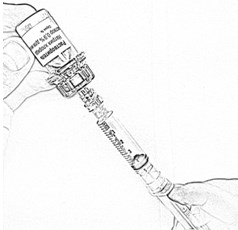
- Осторожно снимите адаптер вместе с наполненным шприцем с флакона с остатком растворителя (рис. 13) и перенесите его на флакон с препаратом (рис. 14), убедившись в проколе пробки (слабый щелчок).
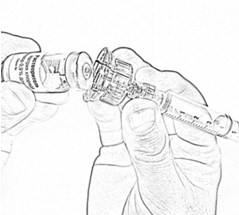
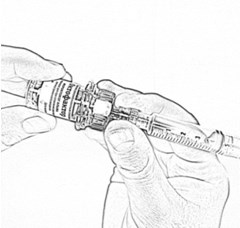
- Осторожно нажимая на стержень поршня и слегка наклоняя флакон, медленно введите 4 мл растворителя по стенке флакона через адаптер (рис. 15). Эффект «вспенивания» появляется, если растворитель попадает непосредственно на лиофилизат.
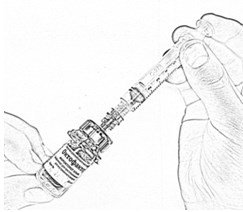
- Осторожно покачивайте флакон круговыми движениями, пока всё вещество не растворится (рис. 16). Не встряхивайте флакон. Убедитесь в том, что порошок полностью растворился. При наличии любых включений или мутности не используйте раствор.
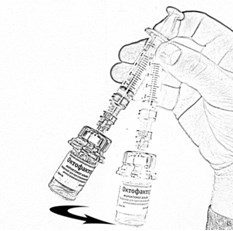
- Держа флакон в слегка наклоненном положении, отберите из него весь раствор в шприц, через адаптер, медленно и плавно оттягивая поршень. Убедитесь в том, что весь приготовленный раствор перешёл в шприц. Удалите воздух из шприца, перевернув флакон вверх дном (рис.17). Отложите флакон со шприцем и адаптером до следующей манипуляции.
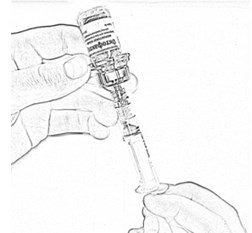
- Откройте блистерную упаковку катетера для периферических вен.
- Не меняя положения поршня (см. п. 14), удалите наполненный шприц из адаптера, оставив переходник в пробке пустого флакона.
Общие положения
- Снимите защитную заглушку с трубки катетера. Присоедините шприц к катетеру, провернув шприц по часовой стрелке до упора (рис.18). Убедитесь в плотности соединения.
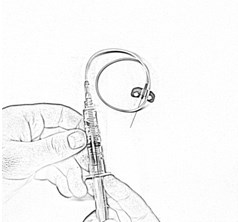
- Обработайте место инъекции прилагаемой салфеткой спиртовой.
- Снимите защитный колпачок с иглы катетера. Удалите воздух из присоединенной системы для внутривенного введения и введите раствор внутривенно струйно медленно (в течение 2-5 минут), закрепив иглу пластырем фиксирующим.
- Обеспечьте безопасную утилизацию всех использованных материалов.
Комплект расходных медицинских материалов для приготовления раствора для внутривенного введения изображен на рисунке 19.
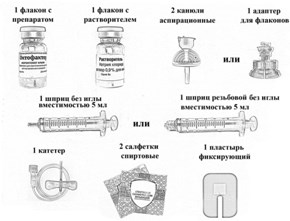
Если необходимо ввести более одной дозы препарата, аналогичным образом приготовьте раствор во флаконе из другой упаковки, используя прилагаемый растворитель, а затем соедините растворы в шприце большего объёма (не прилагается) и введите препарат в обычном порядке.
Приготовленный раствор должен использоваться сразу после разведения. Если инъекция по какой-либо причине откладывается, флакон с раствором препарата следует хранить при температуре от 2 до 8 °С не более 3 часов без замораживания. Неиспользованный за это время раствор не должен применяться, он подлежит утилизации.
Предостережения, контроль терапии
Особые указания
У пациентов, получающих лечение препаратами фактора свёртывания крови VIII, иногда возможно образование активных нейтрализующих антител (ингибиторов), относящихся к иммуноглобулинам G. Клинически это может проявляться в виде недостаточного ответа на терапию. Титр ингибиторов измеряется в единицах Бетезда (БЕ) на мл плазмы крови. Анализ на наличие ингибиторов к фактору свёртывания крови VIII проводится при невозможности достичь ожидаемого уровня активности фактора свёртывания крови VIII или остановить кровотечение при введении адекватно рассчитанной дозы. При наличии высоких концентраций ингибиторов к фактору свёртывания крови VIII (>10 БЕ) терапия Октофактором может оказаться неэффективной. В этом случае может потребоваться повышение дозы препарата или проведение соответствующей специфической терапии. Риск продукции ингибиторов максимален в течение первых 20 дней экспозиции препарата.
Внутривенное введение белковых препаратов, в том числе и Октофактора, может сопровождаться развитием реакции гиперчувствительности. При развитии любых аллергических или анафилактических реакций необходимо немедленно прекратить введение Октофактора и начать соответствующее лечение.
Исследования у лиц пожилого возраста не проводились. Дозу препарата у пациентов старше 55 лет следует подбирать индивидуально.
Влияние на способность управлять транспортными средствами
Исследования влияния препарата на способность к управлению автомобилем и работе с механизмами, требующими повышенной концентрации внимания, не проводились.
Побочные эффекты
По результатам доклинических исследований, в том числе токсикометрических и патоморфологических, Октофактор относится к классу малотоксичных лекарственных средств. Также было установлено отсутствие у Октофактора раздражающего действия, мутагенных и пирогенных свойств.
Применение мороктокога альфа в некоторых случаях может сопровождаться развитием ряда побочных эффектов следующих категорий: очень частые (с частотой ≥1/10), частые (с частотой от ≥1/100 до <1/10) и нечастые (с частотой от ≥1/1000 до <1/100). Внутри каждой категории частоты побочные эффекты приведены в порядке снижения степени их серьезности.
Нарушения со стороны нервной системы
Частые: головная боль.
Нечастые: нейропатия, головокружение, сонливость, изменение вкусового восприятия, повышение потоотделения.
Нарушения со стороны пищеварительной системы
Очень частые: рвота.
Частые: тошнота.
Нечастые: боли в животе, диарея.
Системные нарушения и осложнения в месте введения
Частые: астения, лихорадка.
Нечастые: озноб, воспаление в месте инъекции, реакция в месте инъекции, боль в месте инъекции.
Нарушения со стороны крови и лимфатической системы
Очень частые: продукция ингибиторов фактора свертывания крови VIII у пациентов, ранее не получавших факторы свертывания крови.
Частые: продукция ингибиторов фактора свертывания крови VIII у пациентов, ранее получавших факторы свертывания крови.
Нарушения питания и обмена веществ
Нечастые: анорексия.
Кардиологические нарушения
Нечастые: стенокардия, тахикардия, ощущение сердцебиения.
Нарушения со стороны сосудистой системы
Частые: кровотечения или гематома.
Нечастые: снижение артериального давления, тромбофлебит, вазодилатация, гиперемия.
Респираторные, торакальные и медиастинальные нарушения
Нечастые: одышка, кашель.
Нарушения со стороны кожных покровов
Нечастые: крапивница, кожный зуд, кожные высыпания, гипергидроз.
Нарушения со стороны костно-мышечной системы
Частые: артралгия
Нечастые: миалгия, мышечная слабость.
Изменения лабораторных показателей
Нечастые: повышение активности аспартатаминотрансферазы, повышение активности аланинаминотрансферазы, повышение концентрации билирубина, повышение активности креатинфосфокиназы.
Хирургические операции и медицинские процедуры
Частые: осложнения со стороны сосудистого доступа.
На фоне лечения мороктокогом альфа были получены также сообщения о возникновении следующих нежелательных явлений: парестезии, утомляемость, снижение четкости зрения, акне, гастрит, гастроэнтерит и боли.
Гиперчувствительность и аллергические реакции (возможными проявлениями, которых могут быть: ангионевротический отек, ощущения жжения и стягивания в месте инъекции, озноб, гиперемия, крапивница, головная боль, снижение артериального давления, заторможенность, тошнота, беспокойство, тахикардия, ощущение сдавления в грудной клетке, ощущение покалывания, рвота, свистящее дыхание) отмечались в ходе лечения мороктокогом альфа нечасто. В некоторых случаях они могут прогрессировать до развития тяжелой анафилаксии, в том числе шока.
Передозировка
Случаи передозировки не описаны.
Взаимодействие
Исследование лекарственного взаимодействия не проводилось.
Условия и сроки хранения
В защищенном от света месте, при температуре от 2 до 8 °С. Не замораживать. Допускается хранение препарата в оригинальной упаковке при температуре не выше 25 °С не более 24 часов.
Хранить в местах, недоступных для детей.
Срок годности:
Препарата – 2 года, растворителя – 3 года.
Не использовать позже срока, указанного на упаковке.

Приведенная научная информация, содержащая описание активных веществ лекарственных препаратов, является обобщающей. Содержащаяся на сайте информация не должна быть использована для принятия самостоятельного решения о возможности применения представленных лекарственных препаратов и не может служить заменой очной консультации врача.
