Сердечные гликозиды
Термин сердечные гликозиды (СГ) объединяет растительные вещества и полусинтетические их производные, обладающие специфическим кардиотоническим и антиаритмическим эффектами, которые обусловлены общим механизмом действия.
Долгое время СГ применяли, как основное лекарственное средство для лечения хронической сердечной недостаточности. СГ нормализуют функции сердца, что способствует повышению ударного объема, увеличению переносимости физических нагрузок и снижению риска развития декомпенсации хронической сердечной недостаточности (ХСН). СГ ослабляют чрезмерную симпатическую активность и восстанавливают чувствительность кардиопульмональных рефлексов. Однако, несмотря на то, что кардиотоники на какое-то время улучшают качество жизни больных, продолжительность жизни не только не удлиняется, но при использовании многих «негликозидных» препаратов может даже укорачиваться (частично в результате их аритмогенного действия). В настоящее время кардиотоники все же продолжают применять, но они являются лишь одним из компонентов в комплексном лечении хронической сердечной недостаточности.
Классификация
СГ различаются по своим фармакокинетическим свойствам, которые определяют скорость развития их эффектов, продолжительность действия и способность накапливаться в организме. Узкий терапевтический индекс лекарственных средств и многочисленность факторов, изменяющих их фармакокинетику и чувствительность миокарда к ним, создает высокий риск развития токсических эффектов и обусловливает необходимость регулярного контроля за эффективностью и безопасностью терапии. Все СГ имеют в своей основе стероидное ядро с ненасыщенным лактоновым кольцом и один или несколько гликозидных остатков (сахаров). Основные фармакодинамические эффекты обусловлены стероидной структурой молекулы, а свойства сахаристой части определяют многие фармакокинетические характеристики СГ, такие как скорость и полнота всасывания, прочность связи с белками, особенности метаболизма.
Выделяют:
- Гликозиды длительного действия, при введении которых максимальный эффект при приеме внутрь развивается через 8—12 ч и продолжается до 10 дней и более. При внутривенном введении действие наступает через 30–90 мин, максимальный эффект проявляется через 4–8 ч. К этой группе относятся гликозиды наперстянки пурпурной (дигитоксин и др.), обладающие выраженной кумуляцией.
- Гликозиды средней продолжительности действия, при введении которых максимальный эффект проявляется через 5–6 ч и длится в течение 2–3 дней. При внутривенном введении наступает действие через 15–30 мин, максимальный – через 2–3 ч. К этой группе относятся гликозиды наперстянки шерстистой (дигоксин, целагид и др.), обладающие умеренной кумуляцией. Таким свойством обладают гликозиды наперстянки ржавой и горицвета.
- Гликозиды быстрого и короткого действия – препараты экстренной помощи. Вводят только внутривенно, эффект наступает через 7—10 мин. Максимальное действие проявляется через 1–1,5 ч и длится до 12–24 ч. К этой группе относятся гликозиды строфанта и ландыша, практически не обладающие кумулятивными свойствами.
Также, в соответствии с фармакокинетическими свойствами все СГ делят на 3 группы: группа жирорастворимых ЛС, препараты с умеренной растворимостью в жирах и водорастворимые средства.
Представителями 1-й группы является дигитоксин и бета-ацетилдигитоксин. Ко 2-й группе относятся дигоксин, ланатозид С, метилдигоксин и мепросцилларин, к 3-й — строфантин К и ландыша гликозид.
Не все эти ЛС одинаково широко используются в клинической практике. Частота их применения зависит от степени изученности, фармакокинетических особенностей, доступности, наличия или отсутствия преимуществ перед основными представителями группы. Дигоксин и строфантин являются практически единственными СГ с наиболее изученными характеристиками.
Механизм действия
Механизм действия СГ связан с мощным ингибированием Nа+/К+ - АТФазы — фермента, обеспечивающего перенос ионов натрия и калия через мембрану кардиомиоцита. Блокада работы натриевого насоса приводит к повышению содержания внутриклеточного натрия и снижению натриевого трансмембранного градиента, который в норме создает электродвижущую силу для переноса внутриклеточного кальция через клеточную мембрану во время реполяризации миоцита. Возникающее при этом накопление ионов кальция вызывает усиление сократимости миокардиальных волокон, что и определяет положительное инотропное действие лекарственного средства. СГ в равной степени повышают сократимость миокарда как при ХСН, так и в ее отсутствие.
Однако назначение СГ здоровым людям не сопровождается повышением минутного выброса, так как величина последнего определяется не только силой сердечных сокращений, но и зависит от частоты сердечных сокращений, уровня пред- и посленагрузки. Рефлекторная регуляция этих гемодинамических механизмов препятствует заметному повышению минутного выброса при усилении сократимости здорового сердца. Важным дополнительным механизмом терапевтического действия СГ является их способность снижать нейрогуморальную активность симпатической нервной системы, компенсаторное повышение которой наблюдается при снижении насосной функции сердца ниже уровня, необходимого для поддержания адекватного метаболизма тканей.
Снижение активности симпатической нервной системы не является результатом положительного инотропного действия СГ, а обусловлено их прямым эффектом на чувствительность каротидного синуса. Действие СГ на возбудимость, проводимость и автоматизм объясняется подавлением Nа+/К+ - АТФазы, повышением вагусного тонуса и снижением активности СНС. В терапевтических дозах СГ удлиняют эффективный рефрактерный период и снижают скорость проведения импульсов через атриовентрикулярный узел. Удлинение атриовентрикулярной проводимости проявляется снижением частоты сокращений желудочков при наджелудочковых аритмиях и удлинением интервала P—Q при синусовом ритме.
Дальнейшее угнетение проводимости может привести к брадикардии или полной поперечной блокаде. Важно, что работа сердца повышается на фоне урежения сердечного ритма (отрицательное хронотропное действие) и удлинения диастолы. Это создает наиболее экономный режим работы сердца: сильные систолические сокращения сменяются достаточными периодами «отдыха» (диастолы), благоприятствующими восстановлению энергетических ресурсов в миокарде. Урежение ритма сердечных сокращений в значительной степени связано с кардио-кардиальным рефлексом.
Под воздействием сердечных гликозидов возбуждаются окончания чувствительных нервов сердца и рефлекторно, через систему блуждающих нервов возникает брадикардия. Не исключено, что определенную роль играет усиление рефлексов на сердце с механорецепторов синоаортальной зоны во время систолы в результате повышения артериального давления. На ЭКГ наблюдается увеличение интервала Р-Р. В высоких дозах СГ могут повышать активность симпатической нервной системы и прямо воздействовать на автоматизм сердечной мышцы (отрицательное дромотропное действие). Рефрактерный период предсердно-желудочкового (атриовентрикулярного) узла и предсердно-желудочкового пучка (пучок Гиса) увеличивается. Интервал Р-Q становится более продолжительным. Эти эффекты лежат в основе аритмогенного действия СГ, так как одновременное повышение автоматизма и подавление проводимости в системе Гиса—Пуркинье создают условия для развития тахиаритмий и фибрилляции желудочков. В токсических дозах сердечные гликозиды могут вызывать предсердно-желудочковый блок. Действие СГ на сосудистый тонус определяется как прямыми, так и непрямыми эффектами, которые по-разному реализуются в условиях здорового и декомпенсированного сердца. В отсутствие ХСН СГ проявляют прямое миотропное сосудосуживающее действие на артериолы и вены.
В ряде случаев вазоспастический эффект может сопровождаться повышением конечного диастолического давления, что необходимо учитывать при парентеральном введении ЛС, когда преходящее повышение сосудистого сопротивления и артериального давления может оказаться нежелательным. Этот эффект можно избежать при медленном ведении препарата. В условиях СН действие на сосуды обусловлено непрямыми эффектами СГ. Повышение сократимости миокарда, улучшение гемодинамики и снижение активности симпатической нервной системы, вызываемые СГ, приводят к подавлению механизмов нейрогуморальной вазоконстрикции, что влечет за собой понижение общего периферического сопротивления и венозного тонуса. Снижение посленагрузки, в свою очередь, способствует дальнейшему улучшению работы сердца. СГ оказывают прямое подавляющее действие на канальцевую реабсорбцию натрия, что также связано с подавлением Nа+/К+ - АТФазы. Однако в терапевтических дозах этот эффект СГ проявляется слабо и не имеет самостоятельного клинического значения. Увеличение диуреза, вызываемое СГ, в большей степени обусловлено восстановлением общей и почечной гемодинамики.
Фармакокинетика
Всасывание в организме определяется степенью растворимости СГ. Гидрофильные ЛС практически не всасываются, в связи с чем их необходимо вводить внутривенно. Биодоступность СГ, частично растворимых в жирах, во многом зависит от лекарственной формы препаратов. Наибольшей биодоступностью (до 75%) обладают эликсиры и гелевые инкапсулированные формы. Биодоступность таблетированных ЛС часто не превышает 40—60%. Прием пищи, заболевания, сопровождающиеся нарушением всасывания, и некоторые препараты могут изменять скорость и полноту всасывания СГ. Жирорастворимые СГ способны проникать во все органы и ткани. Они образуют прочные связи с белками плазмы (например, дигоксин на 30-35%, строфантин менее чем на 5%), что определяет длительную циркуляцию в кровотоке и высокую способность к кумуляции.
В большом количестве СГ определяются в миокарде, центральной нервной системе, скелетной мускулатуре. Они способны проходить через плацентарный барьер. ЛС группы дигоксина также имеют большой объем распределения (4—6 л/кг). Они активно проникают во многие органы и ткани организма. Однако благодаря меньшей липофильности ЛС этой группы быстрее выводятся из организма и меньше кумулируются. Основным местом их накопления является скелетная мускулатура, в связи с чем при применении этих ЛС, дозу необходимо рассчитывать исходя из идеальной, а не фактической массы тела. Водорастворимые гликозиды образуют не прочную связь с белками. Время их циркуляции в кровотоке еще меньше. Очень хорошо всасываются более липофильные дигитоксин (90- 95%) и дигоксин (50-80%), хорошо - целанид (20-40%).
Очень плохо всасывается (2-5%) и частично разрушается строфантин. Гликозиды ландыша в пищеварительном тракте в значительной степени разрушаются. Поэтому энтерально целесообразно вводить в основном препараты наперстянки (дигоксин). Внутрь принимают также препараты горицвета (настой травы горицвета). Чем выше липофильность ЛС, тем в большей степени они подвергаются метаболизму в печени. Для дигитоксина как наиболее липофильного препарата характерны не только высокая степень биотрансформации, но и печеночный путь экскреции. Его Т1/2 мало изменяется при заболеваниях почек и печени. Жирорастворимые ЛС частично выделяются в не измененном виде с желчью в просвет кишечника, откуда полностью или частично всасываются обратно в кровь, повторяя печеночно - кишечный круг циркуляции до полного метаболического превращения, что вносит свой вклад в продолжительность действия этих гликозидов. ЛС группы дигоксина значительно слабее метаболизируются и в большой степени выводятся почками в виде активных соединений (около 80 %).
Период полувыведения СГ зависит от функции почек. Существует высокая корреляция между клиренсом креатинина и концентрацией дигоксина в плазме, что помогает корректировать дозы гликозидов этой группы в условиях почечной недостаточности. При сниженной функции почек дозы водорастворимых гликозидов также необходимо корректировать, поскольку они практически полностью экскретируются почками, мало подвергаясь метаболизму.
Скорость развития клинических эффектов и длительность циркуляции СГ в крови зависят от скорости и полноты всасывания, прочности связывания с белками, продолжительности биотрансформации и выраженности печеночно-кишечной циркуляции. Эффекты водорастворимых ЛС развиваются наиболее быстро, в течение нескольких минут, но длительность их пребывания в организме не превышает 1— 3 дней. Действие умеренно жирорастворимых гликозидов развивается медленнее, но они дольше циркулируют в крови и полностью выводятся из организма в течение 7 суток после прекращения приема. Жирорастворимые ЛС, обладающие выраженной способностью к кумуляции и элиминируют из организма через 3—4 недели.
Применение терапевтических доз СГ вызывает повышение концентрации ЛС в организме, продолжающееся до развития стабильного концентрационного равновесия между плазмой крови и периферическими органами и тканями, при котором проявляется полный терапевтический эффект данной дозы СГ. Это состояние, получившее название дигитализации, достигается через 3—5 Т1/2 препарата. При необходимости сократить период дигитализации в первые несколько дней лечения назначают более высокие, насыщающие, дозы с последующим переходом на поддерживающие. Схемы быстрой дигиталицации связаны с более высоким риском развития побочных и токсических явлений и требуют постоянного врачебного контроля.
Место в терапии
применяют сердечные гликозиды в кардиологии, главным образом, как сопутствующий компонент в терапии острой и хронической сердечной недостаточности. При острой сердечной недостаточности СГ вводят с коротким латентным периодом (строфантин, коргликон). Основным препаратом при хронической сердечной недостаточности является дигоксин. Иногда гликозиды (в основном препараты наперстянки) назначают при сердечных аритмиях (при фибрилляции предсердий, при пароксизмальной предсердной и узловой тахикардии). Эффективность гликозидов при указанных аритмиях связана с повышением тонуса блуждающего нерва и угнетением проведения возбуждения по проводящей системе сердца, а также зависит как от резервов самого сердца, так и от причин, лежащих в основе развития сердечной недостаточности. СГ наиболее эффективны в ситуациях, когда СН обусловлена систолической дисфункцией миокарда с дилатацией сердца и снижением фракции выброса (ФВ): постинфарктный и атеросклеротический кардиосклероз, дилатационная кардиомиопатия и др. СГ неэффективны или малоэффективны, если СН протекает с повышенным минутным объемом сердца (гипертиреоз, анемия) или обусловлена нарушением диастолической функции желудочков (митральный стеноз, амилоидоз сердца, выпотной и констриктивный перикардит) либо связана с гипертрофией левого желудочка без выраженной дилатации и снижения ФВ (как при артериальной гипертонии). СГ нецелесообразно применять при СН, вызванной инфекционным или токсическим миокардитом, активным ревматическим процессом или легочным сердцем. СГ не следует назначать не только в остром периоде ИМ, но и в раннем постинфарктном периоде, так как у больных этой категории дигоксин
является независимым фактором повышенного риска смерти. Также СГ не являются ЛС выбора для длительной терапии СН с систолической дисфункцией левого желудочка. Предпочтение, в этом случае, следует отдавать ингибиторам АПФ, которые при необходимости комбинируют с диуретиками и малыми дозами β- блокаторов. И лишь при недостаточной эффективности такой терапии больным с ХСН ФК III—IV по NYHA рекомендуется добавлять к терапии дигоксин. При внутривенном болюсном введении СГ могут увеличивать посленагрузку и вызывать сужение коронарных сосудов. Поэтому следует с большой осторожностью вводить дигоксин внутривенно не только при тяжелой СН, но и больным ишемической болезнью сердца.
Кроме того СГ возможно использовать при наличии у пациента суправентрикулярной тахиаритмии. Несмотря на то, что антиаритмическим эффектом в большей или меньшей степени обладают все СГ, при нарушениях ритма чаще всего используют дигоксин. Наиболее сильное ваготропное влияние дигоксин оказывает на синоатриальный и атриовентрикулярный узлы, поскольку именно в этих структурах парасимпатическая иннервация максимальна. В связи с этим дигоксин может быть полезен при аритмии, в возникновении которой атриовентрикулярный узел играет ключевую роль – АВ-узловая реципрокная тахикардия, фибрилляция и трепетание предсердий. При этом антиаритмический эффект дигоксина проявляется не в восстановлении ритма, а в урежении числа предсердных импульсов, которые могут быть проведены на желудочки в единицу времени. Дигоксин сохраняет свое значение в качестве лекарственного средства, обеспечивающего контроль частоты ритма желудочков у больных с тахикардическими формами наджелудочковых аритмий. Он эффективен при сочетании нарушений ритма и СН независимо от того, связана ли она с дисфункцией левого желудочка или нет, т.е. в случаях, когда другие антиаритмические ЛС, также блокирующие атриовентрикулярный узел (антагонисты кальция и β- блокаторы), могут вызвать ухудшение сердечной деятельности. Антиаритмический эффект дигоксина даже при внутривенном введении развивается достаточно медленно, в связи с чем редко используются для восстановления и поддержания ритма, отдавая предпочтение другим антиаритмикам, например, β- блокаторам, которые более эффективно контролируют желудочковый ритм, особенно при физической нагрузке.
Переносимость и побочные эффекты
Побочные эффекты СГ связаны с передозировкой сердечных гликозидов. Чаще это наблюдается при использовании препаратов наперстянки с выраженной способностью к кумуляции. Они включают брадикардию, удлинение атриовентрикулярного проведения с развитием блокад различной степени, а также аритмогенный эффект. Однако наибольшую опасность представляет возможность развития гликозидной интоксикации. Поскольку СГ относятся к лекарственным веществам с низким терапевтическим индексом, даже небольшое превышение их концентрации в месте действия способно вызвать выраженное токсическое действие. В основе механизма гликозидной интоксикации лежит чрезмерное (более чем на 60%) угнетение мембранной Nа+/К+ - АТФазы миоцитов и нейронов и связанное с этим нарушение транспорта электролитов. Накопление внутриклеточного кальция, натрия и истощение запасов внутриклеточного калия приводит к изменениям, несовместимым с жизнедеятельностью клетки. Токсичность СГ трудно предсказать и диагностировать, поскольку начальные симптомы интоксикации носят неспецифический характер, а мониторирование концентраций препаратов в плазме не дает надежных результатов из-за выраженной вариабельности индивидуальной чувствительности к СГ и большого количества факторов, способных изменять их фармакокинетику. Первыми и наиболее частыми симптомами дигиталисной интоксикации являются потеря аппетита, тошнота, слабость, брадикардия. Интоксикация СГ может проявляться каким-либо одним симптомом или совокупностью нарушений функций желудочно-кишечного тракта, ЦНС, сердца или зрения.
Токсические эффекты СГ
- Кардиальные нарушения (разнообразные нарушения проводимости и ритма сердца аритмии – желудочковая экстрасистолия, атриовентрикулярная блокада разной степени, чрезмерное замедление желудочкового ритма при фибрилляции предсердий, ускоренный атриовентрикулярный ритм, наджелудочковая и желудочковая тахикардия, мерцание предсердий, фибрилляция желудочков, частичный или полный предсердно-желудочковый блок, мерцание желудочков, корытообразное снижение сегмента ST на ЭКГ).
- Экстракардиальные нарушения:
- Желудочно- кишечные: анорексия, дискомфорт и боли в животе, диспепсические явления (тошнота, рвота, диарея).
- Психоневрологические: головная боль, утомляемость, слабость, бессонница, спутанность сознания, боль и парестезии в конечностях, беспокойство, апатия, делирий, галлюцинации, редко судороги.
- Зрительные: выпадение полей зрения, нарушение цветового восприятия.
- Другие: усиление легочной вентиляции в ответ на гипоксию, редко гинекомастия.
Выраженность токсических эффектов СГ в определенной степени зависит от уровня внеклеточного калия, который препятствует связыванию СГ с Nа+/К+ - АТФазой. Таким образом, повышая уровень внеклеточного калия возможно ослабить действие СГ. При наиболее частых проявлениях интоксикации (единичные желудочковые экстрасистолы, экстрасистолы из атриовентрикулярного соединения, атриовентрикулярная блокада I степени, брадисистолическая форма фибрилляции предсердий) необходима временная отмена СГ, ЭКГ-контроль и последующая коррекция дозы препарата для избежания повторных нарушений.
При частой желудочковой экстрасистолии и пароксизмах тахиаритмии назначают препараты калия внутривенно даже в отсутствие гипокалиемии. Они противопоказаны при нарушении атриовентрикулярной проводимости и хронической почечной недостаточности. Для лечения желудочковых аритмий, вызванных дигиталисной интоксикацией и угрожающих нарушением сердечной гемодинамики применяют лидокаин (100 мг внутривенно в виде болюса) и фенитоин (100 мг внутривенно медленно, затем по 100 мг 4—6 р/сут внутрь), оказывающих минимальное действие на проводимость атриовентрикулярного узла.
Антиаритмические лекарственные средства группы хинидина могут быть полезны, но их применение связано с высоким риском развития новых аритмий и блокадой проведения. При наджелудочковых нарушениях ритма применяют β-блокаторы. При атриовентрикулярных блокадах II—III степени вводят атропин (0,5—1 мг внутривенно). Электроимпульсная терапия при интоксикации СГ малоэффективна. Для устранения дигиталисной интоксикации используют также унитиол или иммунологический способ детоксикации — введение моноклональных антител к сердечным гликозидам, нейтрализующих сам препарат. Так, к числу антидотов дигоксина относится один из таких препаратов Digoxin immune fab (Digibind).
Дигиталисная интоксикация может развиться не только в результате передозировки ЛС, но и при приеме терапевтических доз вследствие повышенной чувствительности к ним или изменения их фармакокинетики. Многие заболевания и состояния способны изменять чувствительность миокарда к СГ. Выделяют заболевания и состояния, повышающие риск развития дигиталисной интоксикации.
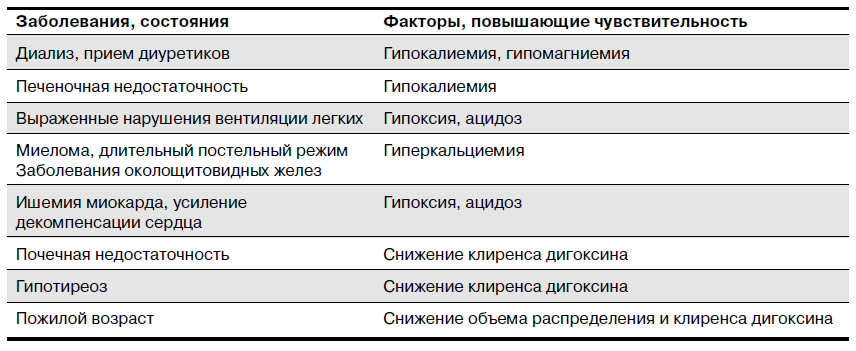
Причиной этого в большинстве случаев являются нарушения электролитного баланса и кислотно-основного состояния, которые стимулируют связывание СГ с Na+/K+ - АТФазой. В результате чрезмерно угнетается регуляция ионного транспорта, что и приводит к развитию симптомов интоксикации. В других случаях причиной повышения чувствительности к СГ является снижение скорости экскреции или метаболизма препарата, приводящее к повышению его концентрации в крови.
Необходимо иметь в виду, что усиление застойных явлений, как и ишемия миокарда, может усугублять гипоксию и ацидоз и способствовать усилению токсических эффектов СГ. Если в пожилом возрасте, как правило, требуются меньшие дозы гликозидов, то детям младшего возраста (от 1 мес до 2 лет) для достижения терапевтического эффекта необходимы более высокие дозы, чем взрослым и детям младше 12 лет (в пересчете на единицу массы тела).
Это связано не только с более низкой чувствительностью миокарда детей к СГ, но и с различиями в их кинетике (объем распределения, общий и почечный клиренс). В то же время при лечении недоношенных и новорожденных детей требуются более низкие дозы гликозидов, что, возможно, связано с более низкой клубочковой фильтрацией почек в этом возрастном периоде и накоплением ЛС.
Противопоказания и предостережения
Противопоказаниями к применению сердечных гликозидов являются неполный предсердно-желудочковый блок, выраженная брадикардия, острый инфекционный миокардит, острый и ранний период инфаркта миокарда или при нестабильной стенокардии, так как состояние ишемии значительно повышает риск токсического действия на сердца.
Не следует назначать СГ для лечения фибрилляции предсердий или трепетании предсердий на фоне синдрома Вольфа—Паркинсона—Уайта, так как они способны укорачивать эффективный рефрактерный период дополнительного пучка и ускорять частоту желудочковых сокращений.
С осторожностью следует использовать сердечные гликозиды с препаратами кальция и при гипокалиемии. Это связано с тем, что при повышенном содержании ионов кальция в сыворотке крови чувствительность миокарда к сердечным гликозидам повышается и соответственно возрастает возможность токсического действия этих препаратов. Аналогичным образом меняется действие сердечных гликозидов при снижении содержания ионов калия (что может возникать при применении мочегонных средств из группы салуретиков, при диарее, в послеоперационном периоде).
Механизм действия
Механизм действия СГ связан с мощным ингибированием Nа+/К+ - АТФазы — фермента, обеспечивающего перенос ионов натрия и калия через мембрану кардиомиоцита. Блокада работы натриевого насоса приводит к повышению содержания внутриклеточного натрия и снижению натриевого трансмембранного градиента, который в норме создает электродвижущую силу для переноса внутриклеточного кальция через клеточную мембрану во время реполяризации миоцита. Возникающее при этом накопление ионов кальция вызывает усиление сократимости миокардиальных волокон, что и определяет положительное инотропное действие лекарственного средства. СГ в равной степени повышают сократимость миокарда как при ХСН, так и в ее отсутствие.
Однако назначение СГ здоровым людям не сопровождается повышением минутного выброса, так как величина последнего определяется не только силой сердечных сокращений, но и зависит от частоты сердечных сокращений, уровня пред- и посленагрузки. Рефлекторная регуляция этих гемодинамических механизмов препятствует заметному повышению минутного выброса при усилении сократимости здорового сердца. Важным дополнительным механизмом терапевтического действия СГ является их способность снижать нейрогуморальную активность симпатической нервной системы, компенсаторное повышение которой наблюдается при снижении насосной функции сердца ниже уровня, необходимого для поддержания адекватного метаболизма тканей.
Снижение активности симпатической нервной системы не является результатом положительного инотропного действия СГ, а обусловлено их прямым эффектом на чувствительность каротидного синуса. Действие СГ на возбудимость, проводимость и автоматизм объясняется подавлением Nа+/К+ - АТФазы, повышением вагусного тонуса и снижением активности СНС. В терапевтических дозах СГ удлиняют эффективный рефрактерный период и снижают скорость проведения импульсов через атриовентрикулярный узел. Удлинение атриовентрикулярной проводимости проявляется снижением частоты сокращений желудочков при наджелудочковых аритмиях и удлинением интервала P—Q при синусовом ритме.
Дальнейшее угнетение проводимости может привести к брадикардии или полной поперечной блокаде. Важно, что работа сердца повышается на фоне урежения сердечного ритма (отрицательное хронотропное действие) и удлинения диастолы. Это создает наиболее экономный режим работы сердца: сильные систолические сокращения сменяются достаточными периодами «отдыха» (диастолы), благоприятствующими восстановлению энергетических ресурсов в миокарде. Урежение ритма сердечных сокращений в значительной степени связано с кардио-кардиальным рефлексом.
Под воздействием сердечных гликозидов возбуждаются окончания чувствительных нервов сердца и рефлекторно, через систему блуждающих нервов возникает брадикардия. Не исключено, что определенную роль играет усиление рефлексов на сердце с механорецепторов синоаортальной зоны во время систолы в результате повышения артериального давления. На ЭКГ наблюдается увеличение интервала Р-Р. В высоких дозах СГ могут повышать активность симпатической нервной системы и прямо воздействовать на автоматизм сердечной мышцы (отрицательное дромотропное действие). Рефрактерный период предсердно-желудочкового (атриовентрикулярного) узла и предсердно-желудочкового пучка (пучок Гиса) увеличивается. Интервал Р-Q становится более продолжительным. Эти эффекты лежат в основе аритмогенного действия СГ, так как одновременное повышение автоматизма и подавление проводимости в системе Гиса—Пуркинье создают условия для развития тахиаритмий и фибрилляции желудочков. В токсических дозах сердечные гликозиды могут вызывать предсердно-желудочковый блок. Действие СГ на сосудистый тонус определяется как прямыми, так и непрямыми эффектами, которые по-разному реализуются в условиях здорового и декомпенсированного сердца. В отсутствие ХСН СГ проявляют прямое миотропное сосудосуживающее действие на артериолы и вены.
В ряде случаев вазоспастический эффект может сопровождаться повышением конечного диастолического давления, что необходимо учитывать при парентеральном введении ЛС, когда преходящее повышение сосудистого сопротивления и артериального давления может оказаться нежелательным. Этот эффект можно избежать при медленном ведении препарата. В условиях СН действие на сосуды обусловлено непрямыми эффектами СГ. Повышение сократимости миокарда, улучшение гемодинамики и снижение активности симпатической нервной системы, вызываемые СГ, приводят к подавлению механизмов нейрогуморальной вазоконстрикции, что влечет за собой понижение общего периферического сопротивления и венозного тонуса. Снижение посленагрузки, в свою очередь, способствует дальнейшему улучшению работы сердца. СГ оказывают прямое подавляющее действие на канальцевую реабсорбцию натрия, что также связано с подавлением Nа+/К+ - АТФазы. Однако в терапевтических дозах этот эффект СГ проявляется слабо и не имеет самостоятельного клинического значения. Увеличение диуреза, вызываемое СГ, в большей степени обусловлено восстановлением общей и почечной гемодинамики.

Приведенная научная информация, содержащая описание активных веществ лекарственных препаратов, является обобщающей. Содержащаяся на сайте информация не должна быть использована для принятия самостоятельного решения о возможности применения представленных лекарственных препаратов и не может служить заменой очной консультации врача.
